
分析 (1)钠和水反应生成氢氧化钠和氢气,据此分析;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(3)氯气与水反应生成HCll、HClO,为氧化还原反应,也属于离子反应;
(4)工业制备漂白粉是利用氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,结合原子守恒配平书写化学方程式;
(5)氯气具有强氧化性,铁在氯气中燃烧生成氯化铁.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)氯气与水反应生成HCll、HClO,化学反应方程式为Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO;
(4)工业制备漂白粉是利用氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查的是化学方程式的书写知识,属于化学用语的考查,考查学生根据反应原理书写化学方程式的能力,注意化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通常状况下的气体摩尔体积约为22.4L | |
| B. | 标准状况下的气体摩尔体积约为22.4L | |
| C. | 相同物质的量的气体气体摩尔体积相同 | |
| D. | 同温同压的气体气体摩尔体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性(酸性溶液):HCl>CoCl2>HI | B. | 酸性(水溶液):CH3COOH>HCN>H2CO3 | ||
| C. | 热稳定性:KCl<KClO4<KClO | D. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 | |
| B. | 上述反应中SiC既是氧化产物又是还原产物 | |
| C. | SiCl4是由极性键构成的非极性分子 | |
| D. | 每生成1mol SiC转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 第一电离能Mg>Al | Mg的3P轨道处于全空状态,能量低,越稳定 |
| C | 熔点Na<Al | 同为金属晶体,Al原子半径小,外围电子多,晶格能大 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
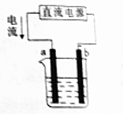
| A. | a为阳极 | |
| B. | 和b相连的电源一极发生还原反应 | |
| C. | 用该装置在铁上镀铜时,b为铁块 | |
| D. | 用该装置点解精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| B. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 邻二甲苯只有一种结构,证明苯环中不存在碳碳单键和碳碳双键交替的结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com