
| A、含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B、无色澄清溶液:CO32-、SO42-、K+、NO3- |
| C、pH=3.8的溶液:NH4+、Na+、NO3-、Fe2+ |
| D、水电离产生的c(H+)=1×10-12 mol?L-1的溶液:HCO3-、NH4+、Cl-、Ca2+ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
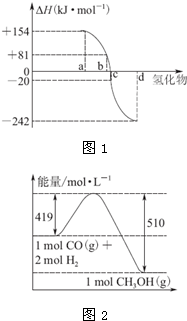 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol 化合物的反应热叫该化合物的生成热(△H).
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol 化合物的反应热叫该化合物的生成热(△H).| 800℃、Ar |
| Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
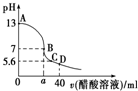 在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
在20mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A、溶液酸性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B、C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-) |
| C、在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在D点:c(CH3COOH)=c(CH3COO-)+2c(OH-)-2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在熔融电解质中,O2-移向负极 |
| B、电池的总反应是:2C4H10+13O2=8CO2+10H2O |
| C、通入空气的一极是正极,电极反应为:O2+4e-=2O2- |
| D、通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
| B、在标准状况下,2.24L辛烷分子数为0.1NA |
| C、1L 0.1mol/L的Na3PO4溶液中含有0.1NA个PO43- |
| D、1mol NaCl中,所有Na+的最外层电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=4 |
| B、Y的化学式为Fe2O3 |
| C、S2O32-是还原剂 |
| D、每32gO2参加反应,转移电子的物质的量为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若反应开始时容器体积为2L,则v(C)=0.4mol/(L?min) |
| B、若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
| C、若2min后,向容器中再投入等物质的量A、C,B的转化率不变 |
| D、若该反应在恒温恒容下进行,放出热量将增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com