
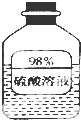
 (1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.
(1)如图信息,瓶中溶液长期放置后溶质质量分数变小,是因为该物质具有吸水性.分析 (1)根据浓硫酸具有吸水性来回答判断;
(2)①H2SO4+BaCl2=BaSO4↓+2HCl,根据沉淀的质量结合化学方程式计算即可;
②废水含有H2SO4、HNO3,硝酸和氯化钡之间不会发生反应,但是硝酸、硫酸和氢氧化钾均反应,据此回答.
解答 解:(1)浓硫酸具有吸水性,瓶中溶液长期放置后,溶质质量不变,但是溶剂质量增加,所以溶质质量分数变小,故答案为:吸水;
(2)①解:设废水中含硫酸的质量为x,
H2SO4+BaCl2=BaSO4↓+2HCl
98 233
x 11.65g
$\frac{98}{x}=\frac{233}{11.65g}$,解得x=4.9g,所以废水中H2SO4的溶质质量分数为$\frac{4.9g}{50g}$×100%=9.8%,答:50g废水中H2SO4的溶质质量分数是9.8%;
②工业废水含有H2SO4、HNO3,硝酸和氯化钡之间不会发生反应,但是改用氢氧化钾,硝酸、硫酸和氢氧化钾均反应,所以测定50g废水消耗的氢氧化钾的量比硫酸消耗的高,即硫酸的含量偏高,故答案为:偏高;废水中含有硝酸,硝酸也会消耗氢氧化钾.
点评 本题涉及浓硫酸的性质以及有关化学方程式的计算知识,注意相关知识的应用梳理是重点,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
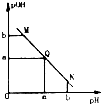 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])与pH的变化关系如图所示,则
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-1g[OH+])与pH的变化关系如图所示,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
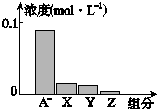 常温下,0.2mol•L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度所示,下列说法正确的是( )| A. | HA为强酸 | B. | 该混合溶液pH=7.0 | ||
| C. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用步行、骑自行车等外出是较为低碳的出行方式 | |
| B. | 防止“白色污染”,将废弃塑料集中到野外焚烧 | |
| C. | 熟石灰可以改良酸性土壤,又能和硫酸铵混合使用 | |
| D. | 微量元素是人体必需的,应尽可能多吃含微量元素的营养补剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S.
2014年3.15晚会的主题为“让消费更有尊严”,食品行业依旧是消费者最为关注的行业.频发的食品安全事件,让公众几乎患上了“食物焦虑症”.国际环保组织绿色和平发布报告,称对“立顿”的绿茶、茉莉花茶和铁观音袋泡茶检验,发现含有被国家禁止在茶叶上使用的高毒农药灭多威.灭多威是一种白色晶状固体,略具有硫磺的气味,其化学式为C5H10N2O2S.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同位素 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com