
 .
. .
.分析 A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,据此解答.
解答 解:(1)A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,
故答案为:H;Al;S;
(2)B为氧原子最外层为6个电子,氧原子的电子式为: ,故答案为:
,故答案为: ;
;
(3)C元素是铝离子结构示意图为: ,故答案为:
,故答案为: ;
;
(4)E元素离子是钾离子,具有相同核外电子排布有S2-、Cl-、Ar、Ca2+,故答案为:S2-;Ca2+.
点评 本题考查结构性质位置关系,元素的推断是解答的关键,题目难度不大,注意信息的综合应用来推断,较好的训练学生分析解决问题的能力,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 将乙烷和氯气的混合气放在光照条件下反应制备氯乙烷(C2H5Cl) | |
| B. | 将乙醇迅速加热至170摄氏度制乙烯 | |
| C. | 将还原铁粉、液溴和苯混合制溴苯 | |
| D. | 检验氯代烃中含氯,加NaOH溶液加热后,用稀硫酸酸化,再检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
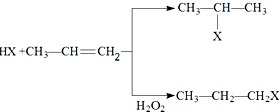 (X为卤素原子)
(X为卤素原子)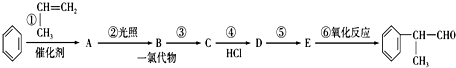
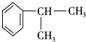 ,E的结构简式
,E的结构简式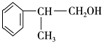 ;
;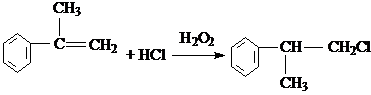 ;
;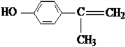 、
、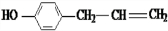 、
、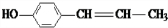 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com