
已知氧化还原反应:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
其中1 mol氧化剂在反应中得到的电子为( )
| A.6 mol | B.5 mol | C.3 mol | D.4 mol |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
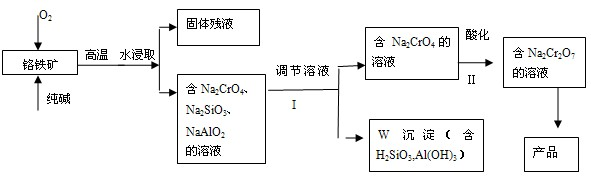
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
| c(Cr2O72-) |
| c2(CrO42-)?c2(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
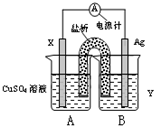 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
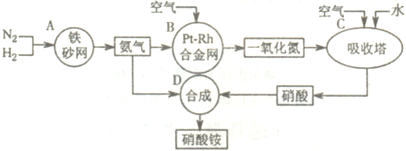
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com