
| A. | Na2CO3溶液 c(Na+ )与 c(CO3)之比为 2:1 | |
| B. | pH=2 和 pH=1 的硝酸中 c(H+)之比为 1:2 | |
| C. | 0.2mol/L 与 0.1mol/L 醋酸中 c(H+)之比为 2:1 | |
| D. | pH=1 的硫酸中加入等体积 0.1mol/L 的 NaOH 溶液,两者恰好完全反应 |
分析 A、碳酸根是弱酸根,在溶液中部分水解;
B、c(H+)=10-pH;
C、醋酸是弱电解质,越稀越电离;
D、硫酸是强电解质,完全电离,故pH=1的硫酸溶液中氢离子的浓度为0.1mol/L,是硫酸中的全部氢离子.
解答 解:A、碳酸根是弱酸根,在溶液中部分水解,故碳酸钠溶液中的c(Na+ )与 c(CO3)之比大于 2:1,故A错误;
B、c(H+)=10-pH,故pH=2的硝酸溶液中,c(H+)=0.01mol/L;而pH=1的硝酸溶液中,c(H+)=0.1mol/L,故两溶液中的c(H+)之比为1:10,故B错误;
C、醋酸是弱电解质,越稀越电离,故0.2mol/L的醋酸溶液中的氢离子浓度小于0.1mol/L醋酸溶液中的氢离子浓度的2倍,即两溶液中的 c(H+)之比小于 2:1,故C错误;
D、硫酸是强电解质,完全电离,故pH=1的硫酸溶液中氢离子的浓度为0.1mol/L,是硫酸中的全部氢离子,和等体积的0.1mol/L的氢氧化钠溶液混合后,两者恰好完全反应,所得溶液显中性,故D正确.
故选D.
点评 本题考查了强弱电解质溶液中的pH和离子浓度的有关计算以及酸碱混合后溶液酸碱性的判断,难度不大,应注意的是等pH和等物质的量浓度的区别.


科目:高中化学 来源: 题型:实验题
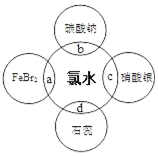
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 镁粉中含少量铝粉:加足量氢氧化钠溶液充分搅拌后过滤 | |
| B. | 碳酸钠溶液中含少量碳酸氢钠:加足量澄清石灰水 | |
| C. | 氯气中混有得氯化氢气体杂质:饱和食盐水 | |
| D. | 硫酸铁溶液中混有硫酸亚铁溶液:通入氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S的电离方程式:H2S+H2O?H3O++HS- | |
| B. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | HS-的水解方程式:HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=0.1mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液:Fe3+、ClO-、Na+、SO42- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
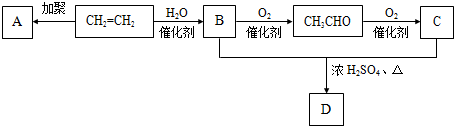
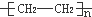 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤① | B. | ①②③④⑤ | C. | ②③①⑤④ | D. | ②①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com