
【题目】(1)配平下列方程式(不需写出配平过程)
________H2S+_______HNO3 =________S↓ +________NO↑ +_______H2O
________S+________KOH=________K2S+________K2SO3 +________H2O
________KMnO4+________HCl(浓)=________KCl+________MnCl2+________Cl2↑+________H2O
(2)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为________________________。
还原为Cr3+,该过程的离子反应方程式为________________________。
【答案】3 2 3 2 4 3 6 2 1 3 2 16 2 2 5 8 Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O
【解析】
(1)根据化合价升降法配平;
(2) 在酸性条件下,Cr2O![]() 与Fe2+反应生成Cr3+、Fe3+和水。
与Fe2+反应生成Cr3+、Fe3+和水。
(1)反应中S的化合价由-2价变为0价,N的化合价由+5变为+2,则最小公倍数为6,则S的系数为3,N的系数为2,根据原子守恒水的系数为4,方程式为3H2S+2HNO3 =3S↓ +2NO↑ +4H2O;
反应中S的化合价由0价变为-2价,S的化合价由0变为+4,则最小公倍数为4,则K2SO3的系数为1,K2S的系数为2,S的系数为3,根据原子守恒KOH的系数为6,水的系数为3,方程式为3S+6KOH=2K2S+K2SO3 +3H2O;
反应中Cl的化合价由-1价变为0价,生成的氯气中,Cl的系数为偶数个,Mn的化合价由+7变为+2,则最小公倍数为10,则KMnO4、MnCl2、KCl的系数为2,Cl2的系数为5,根据原子守恒HCl的系数为16,水的系数为8,方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)在酸性条件下,Cr2O![]() 与Fe2+反应生成Cr3+、Fe3+和水,离子方程式为Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O。
与Fe2+反应生成Cr3+、Fe3+和水,离子方程式为Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】现有一瓶气体为NH3,气体的物质的量为0.2mol。
①气体的质量为______,气体中含氢原子的物质的量为____ mol。
②气体中所含分子数为_____。
③气体在标准状况下的体积为______。
④将气体甲完全溶解于水中形成500mL溶液,所得溶液溶质的物质的量浓度为______ molL-1。
⑤将④中所得溶液取出100mL,加水稀释至1000ml,所得溶液溶质的物质的量浓度为 ______ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制取皮革加工中的鞣化剂硝酸铝,是用铝灰与烧碱、硝酸反应制得的。铝灰是铝、氧化铝和氧化铁的混合物。产品硝酸铝晶体为Al(NO3)3·nH2O。
已知偏铝酸盐能与一般的酸反应,如:NaAlO2+HNO3+H2O→NaNO3+Al(OH)3↓
生产流程如图:
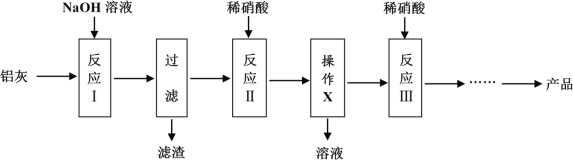
完成下列填空:
(1)用氢氧化钠固体配制30%的氢氧化钠溶液,除烧杯、玻璃棒外还需(选填编号)___。
A. B.
B. C.
C. D.
D.
说出流程中产生的滤渣的一种用途是___。制作一个过滤器需要___。流程中操作x的名称是____。
(2)反应Ⅱ加入的硝酸必须适量,原因是___。反应Ⅲ加入的硝酸要稍过量,原因是___。
(3)从反应Ⅲ所得的溶液制成产品的步骤依次为减压蒸发,___,过滤,___,低温烘干。
(4)为测定所得的产品的纯度,质检人员称取产品Wg,溶于水配成500mL溶液,从中取出25.00mL,加入过量已知浓度的氨水充分反应后,剩余的氨水用已知浓度的盐酸溶液进行测定。通过计算便可得出产品的纯度。
①上述过程属于定量实验。其中除配制一定物质的量浓度的溶液外,还有一个是___,该实验过程中要进行多次读数,读数的方法是读出与___的刻度值。
②任意写出一个该测定过程中所涉及的化学反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式
①纯净的A在B中安静地燃烧生成C_______________
②将气体B通入到水中:__________。
③将气体B通入到NaOH溶液中:_______________________
④将气体B通入到适量石灰乳中:_______________________
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是________(用字母表示)。
(3)将白色浑浊物D溶于水得到澄清溶液,分别取适量该澄清液两份。
①向第一份中滴加碳酸钠溶液观察到出现沉淀,发生反应的化学方程式为______________、________。
②向第二份溶液中滴加硝酸酸化的硝酸银溶液,会观察到____________(填现象)。
③白色浑浊物D因具有漂白性又称为______________,该物质在空气中容易变质的原因为_______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
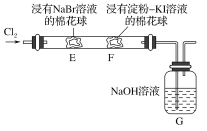
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。W、X、Y、Z均为短周期元素,原子序数依次增加,其中W、X、Z组成的化合物M、N、R之间存在如图所示的反应。下列叙述正确的是
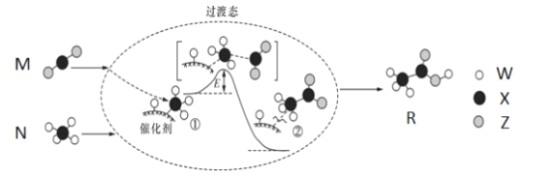
A.元素非金属性的顺序为X>Y>Z>W
B.M、N、R三种分子中,所有原子均满足8电子稳定结构
C.M、N、R三种分子均含有极性键和非极性键
D.W、X、Y、Z四种元素既可形成离子化合物,又可形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应m A(g)+n B(g)![]() p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变 ②体系的密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A. ③④⑤⑥ B. ③④⑥ C. ①③④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质 结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式______。写出C原子的电子排布式______
(2)四种元素中非金属性最强的元素是______,金属性最强的元素是______,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为______。
(4)已知S+6HNO3=H2SO4+6NO2↑+2H2O,该反应表明利用硝酸可以制取硫酸,但该反应不能用于说明氮元素的非金属性比硫元素的强,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
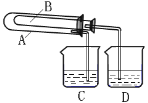
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com