
 .
.时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
分析 (1)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;Cl原子与Si原子可构成有5个原子核的分子为SiCl4;
(2)核外电子轨道排布图可以详尽描述核外电子运动状态的方式;
(3)Na2O和Na2O2的阴阳离子数目之比均为1:2;硅酸盐的氧化物表示方法:先写活泼金属氧化物,然后是不活泼的金属氧化物,再是非金属氧化物二氧化硅,最后是水,注意元素原子比例关系不变;
(4)由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,该转化过程没有气体参与,应使反应物充分接触提高反应速率;
(5)根据勒夏特列原理分析;
(6)铝粉、石墨和二氧化钛按一定比例混合均匀,在高温下煅烧形成耐高温的涂层TiC,由元素守恒开还生成氧化铝.
解答 解:(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故Cl->Na+>Al3+;Cl原子与Si原子可构成有5个原子核的分子为SiCl4,Si形成4个Si-Cl键,没有孤对电子,硅为正四面体构型,
故答案为:Al3+;正四面体;
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态: ,
,
故答案为: ;
;
(3)Na2O和Na2O2的阴阳离子数目之比均为1:2,故二者混合物中阴阳离子数目之比为1:2;
NaAlSi3O8改写成氧化物形式是Na2O•Al2O3•6SiO2,
故答案为:1:2;Na2O•Al2O3•6SiO2;
(4)由表中数据可知,温度越高钾元素的熔出率越高,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,
该转化过程没有气体参与,使反应物充分接触可以提高反应速率,可以充分搅拌,将钾长石粉碎成更小的颗粒,
故答案为:吸热;充分搅拌,将钾长石粉碎成更小的颗粒;
(5)根据勒夏特列原理,将钾蒸气分离出来(降低了产物的浓度),化学平衡向正反应方向移动,
故答案为:根据勒夏特列原理,将钾蒸气分离出来(降低了产物的浓度),化学平衡向正反应方向移动;
(6)铝粉、石墨和二氧化钛按一定比例混合均匀,在高温下煅烧形成耐高温的涂层TiC,由元素守恒开还生成氧化铝,反应方程式为:4Al+3TiO2+3C $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC,
故答案为:4Al+3TiO2+3C $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC.
点评 本题考查核外电子排布、微粒半径比较、空间构型判断、化学平衡影响因素、陌生方程式书写、对信息获取能力等,难度中等,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
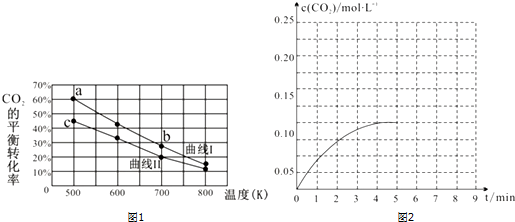
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol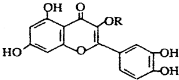 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
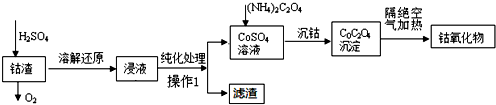
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由A和B两种元素形成的化合物BA5中含共价键 | |
| B. | 含C或E元素的某些物质具有杀菌消毒的作用,其原理相同 | |
| C. | 原子半径:D>C>B,离子半径B>C>D | |
| D. | 由A、C、E三种元素形成的某种化合物AEC,其结构式A-E-C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
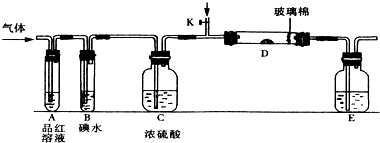
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com