
| A. | 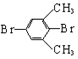 卤代烃 卤代烃 | B. | 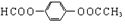 羧酸 羧酸 | C. | 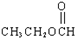 醛 醛 | D. | 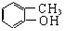 醇 醇 |
分析 A、用卤素原子取代了烃中的H原子而得到的有机产物为卤代烃;
B、含-COOH的有机物为羧酸;
C、醛基-CHO连在链烃基的有机物为醛;
D、-OH连在链烃基或苯环侧链上时为醇.
解答 解:A、用卤素原子取代了烃中的H原子而得到的有机产物为卤代烃, 是用2个溴原子取代了间二甲苯中的两个溴原子而得到的产物,故为卤代烃,故A正确;
是用2个溴原子取代了间二甲苯中的两个溴原子而得到的产物,故为卤代烃,故A正确;
B、含-COOH的有机物为羧酸,而 中含有的官能团为酯基,不含羧基,故不是羧酸,故B错误;
中含有的官能团为酯基,不含羧基,故不是羧酸,故B错误;
C、醛基-CHO连在链烃基或苯环上的有机物为醛,而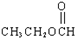 中的官能团为酯基,不是醛基,故C错误;
中的官能团为酯基,不是醛基,故C错误;
D、-OH连在链烃基或苯环侧链上时为醇, 中的-OH直接连在苯环上,故为酚而不是醇,故D错误.
中的-OH直接连在苯环上,故为酚而不是醇,故D错误.
故选A.
点评 本题考查了常见物质的官能团,应注意的是含醛基的不一定是醛,只有当醛基连在链烃基或苯环上上时才是醛.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
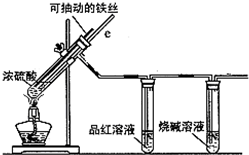 某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
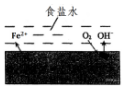 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )| A. | 铁片发生还原反应而被腐蚀 | |
| B. | 此过程中电子从C移向Fe | |
| C. | 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-═4OH- | |
| D. | 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com