
| A、①②③④⑤ |
| B、②③④⑥⑦ |
| C、②③⑤⑥⑦ |
| D、①②⑤⑥⑦ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、放热反应均是自发反应 |
| B、△S为正值的反应均是自发反应 |
| C、放热且熵增加的反应一定是自发反应 |
| D、吸热且熵增加的反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素形成的简单离子半径按照D、C、B、A的顺序逐渐减小 |
| B、A与其它元素形成的二元化合物的晶体类型相同 |
| C、Z气体通入BaCl2溶液中无现象,再滴入FeCl3溶液则可看到有沉淀产生 |
| D、X的水溶液和Y的水溶液一种呈酸性另一种呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释醋酸钠溶液,CH3COO-水解程度变大,故溶液的PH增大 |
| B、由水电离的c(H +)=1×10-11mol?L-1的溶液一定是碱性溶液 |
| C、两种难溶性盐Ksp较小的其溶解度也一定较小 |
| D、等体积.等物质的量浓度的Na2CO3和NaHCO3溶液混合后,存在关系式:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2SO3) |
| c(HSO3-) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是最简单的芳香胺,暴露于空气中变为棕色,该变化最有可能与苯胺具有
)是最简单的芳香胺,暴露于空气中变为棕色,该变化最有可能与苯胺具有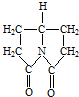 写出该有机物在酸催化下水解产物的结构简式
写出该有机物在酸催化下水解产物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com