
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中
定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
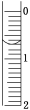
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________;按正确数据处理,可得市售白醋总酸量=_____g/100 mL。(结果保留四位有效数字)
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:选择题
分子式为C5H8O2 的有机物,能使溴的CCl4 溶液褪色,也能与NaHCO3 溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)最多有
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
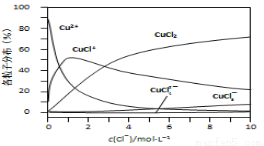
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
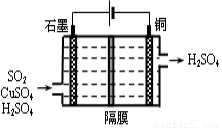
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高中高三上学期第三次模拟理综化学试卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
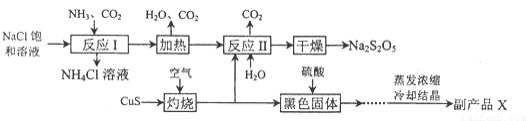
已知:反应II包含2NaHSO3=Na2S2O5+ H2O等多步反应。
(1)反应I的总化学方程式为 ,反应I进行时应先通入的气体是 ,反应I产生的NH4Cl可用作________。
(2)灼烧时发生反应的化学方程式为 ,若灼烧时生成SO21.12×l06 L(标准状况下),则转移电子 mol。
(3)己知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为 。
(4)副产品X的化学式是 ,在上述流程中可循环使用的物质是____。
(5)为了减少产品Na2S205中杂质含量,需控制反应II中气体与固体的物质的量之比约为 ,检验产品中含有碳酸钠杂质所需试剂 。(填编号)。
①澄清石灰水 ②饱和碳酸氢钠溶液 ③氢氧化钠 ④酸性高锰酸钾 ⑤稀硫酸
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列说法正确的是( )
A.Cu与Cu2O 的物质的量之比为1:2
B.产生的NO的体积为4.48L
C.硝酸的物质的量浓度为2.6mol/L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:推断题
某研究小组为了探究固体甲(二元化合物)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:

已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式 ,气体1的结构式 。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为 。
(3)乙的化学式 。
(4)足量气体2与溶液1反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:填空题
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ NA+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- OH- Cl- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ____,D 。
(2)C可用作净水剂,用离子方程式表示其净水原理____ ___。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
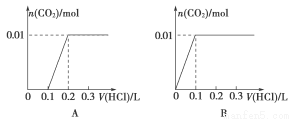
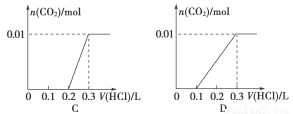
(4)在m mL B mol·L-1 C溶液中,加入等体积A mol·L-1 的E溶液。当A≤3B时,生成沉淀的物质的量是 mol;当3B<A<4B件时,生成沉淀的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
与Ne的核外电子排布相同的离子跟与Ar核外电子排布相同的离子所形成的是化合物可以是
A.MgBr2 B.Na2S C.CCl4 D.KCl
查看答案和解析>>
科目:高中化学 来源:2016届山东省德州市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.SiO2和NO2能与强碱溶液反应,都是酸性氧化物
B.不锈钢材料因含有铬、镍所以抗腐蚀性好
C.普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐
D.MgO和Al2O3熔点较高都可以做耐火材料,都能和强碱溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com