
| A. | 盐酸滴入NaAlO2溶液中 | B. | CO2气体通入漂白粉溶液中 | ||
| C. | NaOH溶液滴入AlCl3溶液中 | D. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
分析 A.偏铝酸钠溶液中滴入盐酸,先生成氢氧化铝沉淀,继续滴加氢氧化铝溶解;
B.漂白粉溶液含有次氯酸钙,通入二氧化碳先生成碳酸钙,最终生成碳酸氢钙;
C.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失;
D.硫酸铝溶液中滴入氢氧化钡溶液过程中一定有硫酸沉淀生成.
解答 解:A.偏铝酸钠溶液中滴入盐酸,先生成氢氧化铝沉淀,继续滴加氢氧化铝溶解,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓;Al(OH)3+3H+=Al3++3H2O,故A不选;
B.漂白粉溶液含有次氯酸钙,通入二氧化碳先生成碳酸钙,最终生成碳酸氢钙,故B不选;
C.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量,先生成白色沉淀后沉淀消失,故C不选;
D.硫酸铝溶液中滴入氢氧化钡溶液过程中一定有硫酸沉淀生成,会出现沉淀减少但不会出现沉淀全部溶解消失的现象,故D选.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中CH3COO-和Na+的数目 | |
| B. | 纯水在80℃和25℃时的pH | |
| C. | 相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸中H+的物质的量 | |
| D. | 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
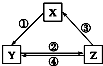 不能实现如图所示的变化的是( )
不能实现如图所示的变化的是( ) | 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26:9 | B. | 39:9 | C. | 40:9 | D. | 53:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
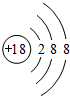
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| B. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| C. | C、H之间形成的是s-p σ键,C、C之间的π键是未参加杂化的2p轨道形成的 | |
| D. | C、C之间形成的是sp2-sp2σ键,C、H之间是未参加杂化的2p轨道形成的π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
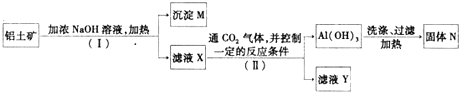
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com