
| ||

| ||


科目:高中化学 来源: 题型:
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )| A、该电池工作时将化学能转化为电能 |
| B、电流从电极b经外电路流向电极a |
| C、该电池中的电极b是正极 |
| D、在电极a上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用18.4mol?L-1的硫酸 |
| B、升高溶液的温度 |
| C、向溶液中加入少量铜粉 |
| D、把锌块(片)换成锌粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 步骤 | 现象 | 化学方程式 |
| 正确顺序是: |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 小明为测定某牙膏中碳酸钙的质量分数,取该牙膏25克,加入200mL稀盐酸,恰好完全反应(其他成分不与盐酸反应),共收集到标准状况下3.36L二氧化碳气体,请通过计算说明:
小明为测定某牙膏中碳酸钙的质量分数,取该牙膏25克,加入200mL稀盐酸,恰好完全反应(其他成分不与盐酸反应),共收集到标准状况下3.36L二氧化碳气体,请通过计算说明:查看答案和解析>>
科目:高中化学 来源: 题型:
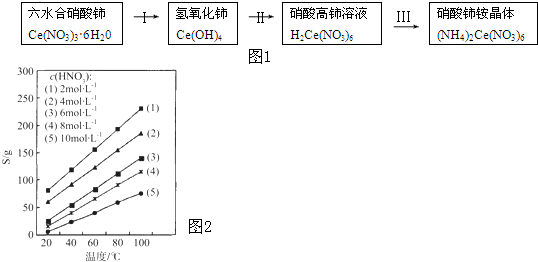
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Fe3+、NO3-、SO42- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Na+、K+、CH3COO-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com