
 (1)10.0 g(2分); 胶头滴管、500 mL容量瓶(1分);
(1)10.0 g(2分); 胶头滴管、500 mL容量瓶(1分);

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸蘸取NaOH溶液,立刻与比色卡对比,测定NaOH溶液的Ph |
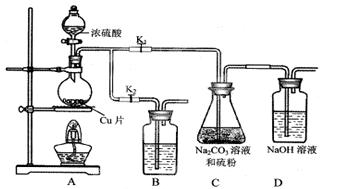
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.均不能采取将溶液直接蒸干的方法制得AIC13、A12(SO4)3、FeC13、Fe2(SO4)3 |
| D.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑥ | B.①③ | C.①③⑤ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 |
| B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测定 |
| C.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 |
| D.加入盐酸可以除去硫酸钠中的少量碳酸钠杂质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用量筒量取5.0mL浓硫酸并直接在量筒中稀释 |
| B.称量NaOH固体时,将药品直接放在托盘上 |
| C.给烧瓶里的液体加热时,垫上石棉网 |
| D.用嘴吹灭燃着的酒精灯火焰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
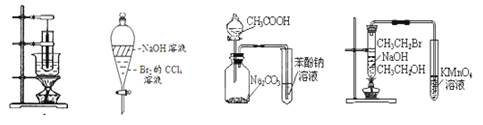
| A.图1为实验室制备硝基苯的装置 |
| B.图2中振荡后下层为无色 |
| C.图3装置可以达到验证酸性:CH3COOH > H2CO3 > C6H5OH的目的 |
| D.图4装置可以达到验证溴乙烷发生消去反应生成烯烃的目的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用100 mL量筒量取5.26 mL稀硫酸溶液 |
| B.用托盘天平称取11.7 g CuO粉末 |
| C.用广泛pH试纸测得溶液的pH为3.5 |
| D.温度计上显示的室温读数为25.68 oC |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com