
| A. | 硫酸氢钠与苛性钾溶液反应 | B. | 醋酸和氢氧化钾溶液反应 | ||
| C. | 稀硫酸和氨水反应 | D. | 碳酸氢钠溶液与烧碱溶液反应 |
分析 离子方程式H++OH-=H2O表示可溶性强碱与强酸反应生成可溶性盐和水的一类反应,酸必须是强酸,碱必须为可溶性的强碱,据此进行判断.
解答 解:A.硫酸和氢氧化钾都是可溶性的强电解质,反应生成了水和可溶性的硫酸钾,该反应可用离子方程式H++OH-=H2O表示,故A正确;
B.醋酸是弱酸,离子方程式中保留分子式,反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能够用离子方程式H++OH-=H2O表示,故B错误;
C.氨水为弱碱,反应的离子方程式为:NH3•H2O+H+═NH4++H2O,不能用离子方程式H++OH-=H2O表示,故C错误;
D.碳酸氢钠与氢氧化钾的反应中,碳酸氢根离子不能拆开,该反应不能用离子方程式H++OH-=H2O表示,故D错误;
故选A.
点评 本题考查了离子方程的书写,题目难度中等,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,试题侧重对学生能力的培养和训练,有利于培养学生规范答题的能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医疗上常用碳酸钡作X射线透视肠胃的内服药剂,即钡餐 | |
| B. | 石油的分馏产品如汽油、煤油、柴油等都是纯净物 | |
| C. | 食物的变质腐败属于吸热过程 | |
| D. | 硅的提纯与应用,促进了半导体元件与集成芯片的发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量CuSO4固体 | B. | 用锌粉代替锌粒 | C. | 加水稀释H2SO4 | D. | 适当加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与FeCl3溶液的反应:Fe+2Fe3+═3Fe2+ | |
| B. | 碳酸钙与盐酸的反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 硝酸与氢氧化铜的反应:2H++Cu(OH)2═Cu2++2H2O | |
| D. | 金属Na投入水中的反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
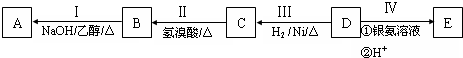
 ;
; 和
和 ;
;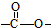 结构的有12种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为
结构的有12种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
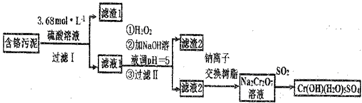
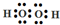 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com