
һ���¶���,��һ�ݻ�Ϊ5 L�ĺ����ܱ������г���0.4 mol SO2��0.2 mol O2,������Ӧ:2SO2(g)+O2(g) 2SO3(g) ��H="-196" kJ��mol-1������Ӧ�ﵽƽ��ʱ,������ѹǿ��Ϊ��ʼʱ��0.7������ش���������:
2SO3(g) ��H="-196" kJ��mol-1������Ӧ�ﵽƽ��ʱ,������ѹǿ��Ϊ��ʼʱ��0.7������ش���������:
(1)�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� (����ĸ)��
a.SO2��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2
b.�����������ѹǿ����
c.�����ڻ��������ܶȱ��ֲ���
d.SO3�����ʵ������ٱ仯
e.SO2���������ʺ�SO3�������������
(2)��SO2��ת����Ϊ ;�ڴﵽƽ��ʱ��Ӧ�ų�������Ϊ ;�۴��¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
(3)��ͼ��ʾƽ��ʱSO2�����������ѹǿ���¶ȱ仯������,��: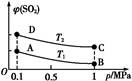
���¶ȹ�ϵ:T1 T2(���������������=��,��ͬ);
��ƽ�ⳣ����ϵ:KA KB,KA KD��
 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£����ݻ��̶���V L�ܱ����������n mol A��2n mol B��������Ӧ��A(g)��2B(g) 2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��
2C(g)����H<0����Ӧ��ƽ�����ƽ�ⳣ��ΪK����ʱA��ת����Ϊx��
(1)K��x�Ĺ�ϵ����K��________���ڱ�֤AŨ�Ȳ��������£����������������ƽ��________(����ĸ)��
A��������Ӧ�����ƶ�
B�����淴Ӧ�����ƶ�
C�����ƶ�
(2)���÷�Ӧ���淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��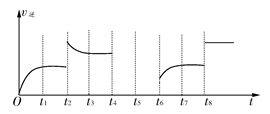
�ٿɼ���Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬��t2��t8ʱ���ı���һ�����������жϸı����ʲô������
t2ʱ________________��
t8ʱ________________��
��t2ʱƽ����________(�����Ӧ�����淴Ӧ��)�����ƶ���
����t4ʱ��ѹ��t5ʱ�ﵽƽ�⣬t6ʱ����Ӧ���Ũ�ȣ�����ͼ�л���t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ�ߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�Ϻϳɰ��ķ�Ӧ��N2(g)��3H2(g)  2NH3(g)��H����92.60 kJ��mol��1��
2NH3(g)��H����92.60 kJ��mol��1��
��1���ھ��ȡ��ݻ��̶����ܱ������з�����Ӧ��N2(g)��3H2(g)  2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
2NH3(g)������˵����˵��������Ӧ������Ӧ������е���________(�����)��
�ٵ�λʱ��������2n mol NH3��ͬʱ����3n mol H2
�ڵ�λʱ��������6n mol N��H����ͬʱ����2n mol H��H��
����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
�ܻ�������ƽ��Ħ����������
�������ڵ������ܶȲ���
��2����֪�ϳɰ���Ӧ��ij�¶���2 L���ܱ������н��У�����������ݣ�
| ʱ��(h) ���ʵ���(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶���2 L�ĺ�����������,����2 mol̼��2 mol CO2�������·�Ӧ: C(s)+CO2(g)  2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��
2CO(g)����H>0,���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��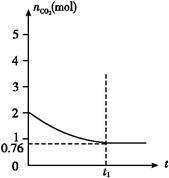
(1)�÷�Ӧ�Ħ�S����0(�>������<����=��)������������(��ϸߡ��ϵ͡�)�¶��������ڸ÷�Ӧ�Է����С�
(2)��ʽ�����������¶��´˷�Ӧ��ƽ�ⳣ������������������������(�������һλС��)��
(3)������ƽ����ϵ����ͨ��CO2,��CO2��ת������������(���������С���������䡱����ȷ����)��
(4)��ͬ�¶���,2 L�ĺ����������м���4 mol̼��4 mol CO2,�ﵽƽ�⡣����ͼ�л�����������CO2�����ʵ�����ʱ��t�仯��ϵ��Ԥ�ڽ��ʾ��ͼ��(ע��ƽ��ʱCO2�����ʵ���)
(5)��ͬ�¶���,2 L�ĺ����������м���4 mol̼��4 mol CO2��4 mol CO����ʼ��Ӧʱv���������� v��(�>������<����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��¯�����з����Ļ�����Ӧ֮һΪ:FeO(s)+CO(g) Fe(s)+CO2(g)��H��0����֪1 373 KʱK=0.263��
Fe(s)+CO2(g)��H��0����֪1 373 KʱK=0.263��
(1)�÷�Ӧ��ƽ�ⳣ������ʽΪ ��
(2)�¶����ߣ���ѧƽ���ƶ���ƽ�ⳣ��Kֵ (���������С�����䡱)��
(3)1 373 Kʱ��ø�¯��c(CO2)="0.025" mol/L��c(CO)="0.1" mol/L������������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬ (��ǡ���)����ʱ����ѧ��Ӧ����v(��) v(��)(����ڡ��������ڡ���С�ڡ�)����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ���������İ�������粒����������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��  2NH3��g����CO2��g��
2NH3��g����CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶�/�� | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹ ǿ/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ��/mol�� L��1 | 2.4�� 10��3 | 3.4�� 10��3 | 4.8�� 10��3 | 6.8�� 10��3 | 9.4�� 10��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���¿�����Ⱦ����Ҫԭ�������ڻ�ʯȼ��ȼ�ա����Ṥҵ������β�����ŷţ���ʹ������������͵���������������С����û�ѧ��Ӧԭ���о�����������Ⱦ�ķ����ǵ�ǰ������������Ҫ�о�����֮һ��
��1����Ӧ �����Ṥҵ�е���Ҫ��Ӧ�����SO2��ƽ��ת���������ڼ���β���ŷţ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ�����÷�Ӧ����ƽ��״̬ʱ��Ϊ�����SO2��ת���ʣ����пɲ��õĴ�ʩ��
�����Ṥҵ�е���Ҫ��Ӧ�����SO2��ƽ��ת���������ڼ���β���ŷţ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ�����÷�Ӧ����ƽ��״̬ʱ��Ϊ�����SO2��ת���ʣ����пɲ��õĴ�ʩ��
A������V2O5������ B��ͨ��������� C������ D������ѹǿ
��2��һ�������£���2L�ܱ�������ͨ��2molSO2(g)��1molO2(g)��0.2SO3(g),2min��Ӧ�ﵽƽ��ʱ,���SO2��ת����Ϊ50%����ÿ��淴Ӧ��ƽ�ⳣ��K=_________����O2��Ũ�ȱ仯��ʾ��O-2min�ڸ÷�Ӧ��ƽ������v=_________�������£������������ټ���2molSO2(g)�������´ﵽƽ��ʱSO2����ת����____________50%(�>������<������=��)
��3����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����
A�� B��������ѹǿ���ֲ��䣮
B��������ѹǿ���ֲ��䣮
C�� D�����������ʵ��ܶȱ��ֲ��䣮
D�����������ʵ��ܶȱ��ֲ��䣮
��4���ڴ�����������CH4���������ﻹԭΪN2�����������������������Ⱦ�� ��д��CH4��NO��Ӧ�Ļ�ѧ����ʽ��_________���¶�ΪT1ʱ���ܱ��������о�CH4����ԭ��������ķ�Ӧ����Ӧ�����в���N2�����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�в������¶�ΪT2(T2>T1)ʱ��n(N2)�ı仯���ߣ���֪�÷�Ӧ�Ƿ��ȷ�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��100 ����������½�0.100 mol��N2O4�������Ϊ1 L������ܱ������У�������Ӧ��N2O4(g) 2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2(g)����H��0����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
| t/s c/(mol��L��1)���� | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol��L��1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol��L��1) | 0 | 0.060 | b | c1 | c2 | c3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������̶����ܱ������У��������»�ѧ��Ӧ��N2O4��g�� 2NO2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NO2��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t /�� | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 2.80 | A | 2.00 | c | d | 1.60 |
| n��NO2�� | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com