
 .
. 分析 (1)铁离子和硫离子发生氧化还原反应生成S单质和Fe2+;
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-.
解答 解:(1)铁离子和硫离子发生氧化还原反应,方程式为2Fe3++S2-═2Fe2++S↓,其中氧化产物为S,故答案为:2Fe3++S2-═2Fe2++S↓;S;
(2)溶液变红是因为亚铁离子被氧化为铁离子,铁离子与硫氰根离子形成络合物Fe(SCN)3,SCN-中的硫-2价→+6价,C的化合价未变,氮-3价→0价,升高(6+2)×2+3×2=22,所以生成1mol氮气,转移电子物质的量是22mol,故答案为:Fe(SCN)3;22;
(3)由(1)知还原性S2->Fe2+,又因为向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生,首先反应的量亚铁离子,然后才氧化硫氰根离子,故还原性Fe2+>SCN-,综上所述还原性强弱顺序为:S2->Fe2+>SCN-,故答案为:S2->Fe2+>SCN-;
(4)氯气的强氧化性将铁离子氧化为正六价的K2FeO4,氢氧化铁是还原剂,氯气是氧化剂,1mol氢氧化铁失去3mole-,配平并标出电子转移的数目和方向为 ,故答案为:
,故答案为:
点评 本题考查铁及化合物的性质,亚铁离子的检验、微粒还原性的强弱和氧化还反应中电子转移数目和方向,难度适中.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
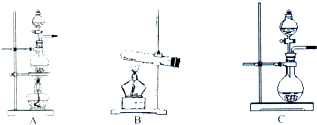 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(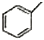 )的一氯代物 )的一氯代物 | D. | 立体烷(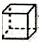 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

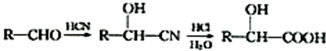
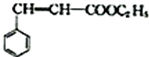
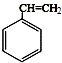 ;C 的化学名称为苯乙醛.
;C 的化学名称为苯乙醛.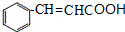 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.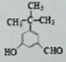
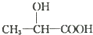 )的路线(其他试剂任选)
)的路线(其他试剂任选)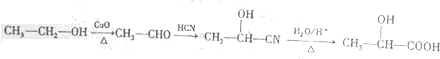 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com