
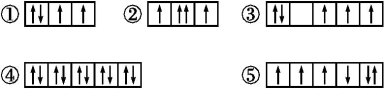
(14分)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 ,违反了洪特规则的是 。
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:填空题
(16分)氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200°C,导热性好,热膨胀系数小,是良好的耐热冲击材料。抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料。工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是______________。
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,请写出AlN与NaOH溶液反应的化学方程式___________。
(2)实验装置(如下图所示)

(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xgAlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量 _______(填化学式),与锥形瓶内物质充分反应。
④打开K2,通过打气装置通入空气一段时间。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是__________。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积_________(填“偏大”,“偏小”或“无影响”)。
③Al4C3的质量分数为 ____,AlN的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2016届河南省八市高三9月教学质量监测考试化学试卷(解析版) 题型:选择题
向含有c(FeCl3)=0.2 mol·L-l、c(FeCl2)=0.1 mol·L-l的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为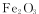
B.加入NaOH时发生的反应可能为: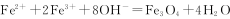
C.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
D.可用过滤的方法将黑色金属氧化物与Na+分离开
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三第一次联考化学试卷(解析版) 题型:填空题
(12分)
(l)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系,为了减少污染,可尝试使用汽车尾气净化装置,其原理如图所示。

写出净化过程中的总化学反应方程式 。
(2)目前科学家也在尝试用Cu+做催化刘,将汽车尾气中NO2转化为无毒的N2,其原理如下图所示:
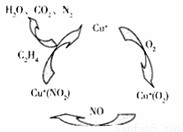
①该过程中,还原剂是 《填物质名称).
②若某辆汽车的NO排放为0.09g/km.则该车行驶100km.完成上述转化理论上需消耗乙烯的质量为 g.
(3)为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究.
[查阅资料]雾霾颗粒样品中可能含有 及一种常见阳离子
及一种常见阳离子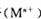 .现进行如下实脸
.现进行如下实脸
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是 _,肯定没有的离子是_ .
②若气体D遇空气会空成红棕色,则沉淀A中一定含有_ (填化学式).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市高三第一学期第一次月考化学试卷(解析版) 题型:选择题
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2
下列说法正确的是
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0.2 mol硫被氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省白城市高一上第一次月考化学试卷(解析版) 题型:选择题
下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是
A.500mL溶液中Cl-离子浓度为0.2mol·L-1
B.500mL溶液中Ba2+离子浓度为0.2mol·L-1
C.500mL溶液中Cl-离子总数为0.2NA
D.500mL溶液中Ba2+和Cl-离子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北正定中学高二上学期第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下反应,起始时醋酸与锌反应的速率大
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三第一次质量检测化学试卷(解析版) 题型:实验题
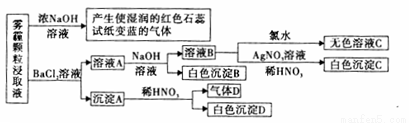
(19分) 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 __ __,发生反应的离子方程式为________。加高锰酸钾溶液前,若pH较低,对除杂的影响是_________。
(2)反应③的反应类型为___________ ,过滤得到的滤渣中,除了过量的锌外还有__________ 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 _________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1 g.则x等于 _________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次月考化学试卷(解析版) 题型:填空题
(16分)“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如右图所示。
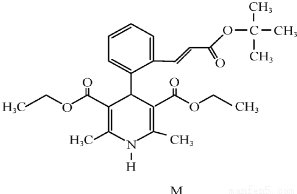
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物 b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:

已知: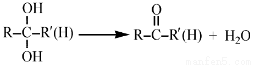
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________.
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com