
 MnCl2 + C12↑ + 2H2O。下列说法不正确的是( )
MnCl2 + C12↑ + 2H2O。下列说法不正确的是( ) | A.还原剂是HCl,氧化剂是MnO2 |
| B.每生成1 mol Cl2,转移电子的物质的量为2 mol |
| C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol |
| D.转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物质量为n(3x+1)mol | B.处理废水中Cr2O72-的物质量为 mol mol |
| C.反应中发生转移的电子数为1.5nxmol | D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cu2S + 3CuSO4 + 4H2O的叙述正确的是
Cu2S + 3CuSO4 + 4H2O的叙述正确的是| A.氧化剂与还原剂的物质的量之比为1:5 |
| B.每有1 mol Cu参加反应时转移2 mol e- |
| C.氧化产物只有CuSO4 |
| D.浓硫酸既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,则a、b、c、M可能分别为( )
,则a、b、c、M可能分别为( )| A.4、1、5、N2O | B.4、2、4、NO2 |
| C.4、1、3、NH4NO3 | D.4、3、5、NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
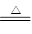 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+4 | B.+5 | C.+6 | D.+7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.16 mol NH3 | B.8 mol NH3 | C.4 mol NH3 | D.3 mol NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com