
 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)注明物质的聚集状态与反应热书写热化学方程式;
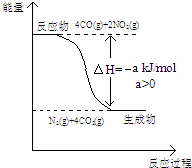
(2)发生反应:4CO+2NO2=N2+4CO2,计算CO物质的量,根据C元素化合价变化计算转移电子;由图可知4mol CO反应时放出热量为a kJ,进而计算放出热量;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1.
解答 解:(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol;
(2)发生反应:4CO+2NO2=N2+4CO2,CO物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ×$\frac{0.1mol}{4mol}$=0.025a kJ,
故答案为:2,0.025a;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,则(-574KJ•mol-1+△H2)×$\frac{1}{2}$=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol.
点评 本题考查反应热有关计算、热化学方程式书写等,注意对盖斯定律理解与灵活应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O的原子个数之比一定为1:4:4 | |
| B. | 一定为烃类 | |
| C. | 分子中一定含有氧原子 | |
| D. | 分子式为CH4Ox(x=0、1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++SO42- | B. | NaHCO3═Na++HCO3- | ||
| C. | Na2CO3═2Na++CO32- | D. | CH3COOH═H++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
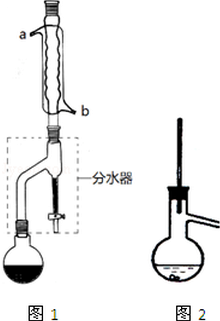 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com