
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,可使硬水软化 | |
| D. | 只具有永久硬度的水经加热煮沸后,可变成软水 |
分析 A.碳酸氢钙不稳定,可分解;
B.明矾水解生成的胶体具有吸附性;
C.用离子交换剂处理硬水,可降低水中钙离子、镁离子的含量;
D.具有暂时硬度的水经加热煮沸后,钙、镁离子转化为沉淀.
解答 解:A.碳酸氢钙不稳定,可分解,含有少量碳酸氢钙和氯化钙的水是暂时硬度的水,故A错误;
B.明矾中铝离子水解生成胶体,具有吸附性,不能降低钙、镁离子浓度,不能软化硬水,故B错误;
C.离子交换剂处理硬水,可降低钙、镁离子浓度,则能软化永久硬水,故C正确;
D.具有暂时硬度的水经加热煮沸后,钙、镁离子转化为沉淀,则能软化硬水,而具有永久硬度的水不能加热软化,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握硬水的软化方法为解答的关键,侧重分析与应用能力的考查,注意分离方法及原理,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 1、2 | B. | 3、4 | C. | 1、1 | D. | 3、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-101.5 kJ•mol-1,该方程式的△H可表示碳的燃烧热 | |
| C. | 已知:C(s)+O2(g)=CO2(g)△H1C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| D. | Ba(OH)2(aq)+H2SO4(aq))=BaSO4(s)+2H2O(l)△H=-2a kJ•mol-1,则任何强酸和强碱发生中和反应生成1 mol H2O(l)的反应热均为-a kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
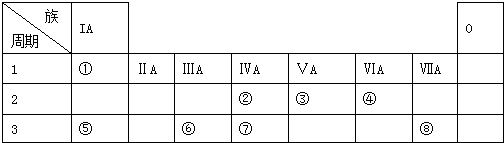
 .
.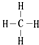 .
.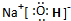 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com