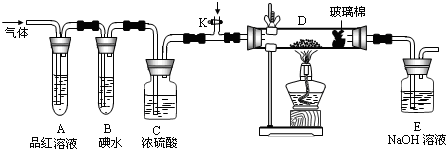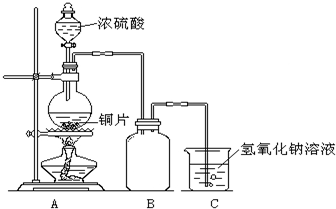
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L
-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
Cu+2H
2SO
4(浓)
CuSO
4+SO
2↑+2H
2O
,
实验中若有m g铜参加了反应,则有
mol硫酸被
还原
还原
(填“氧化”或“还原”),转移电子的物质的量为
mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是
D
D
(填写字母编号).
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
稀硫酸不与铜反应
稀硫酸不与铜反应
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
;
方案二
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
.
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)
.

![]() 浓度增大而产生沉淀
浓度增大而产生沉淀 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案 Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)
Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)


 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验: