
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
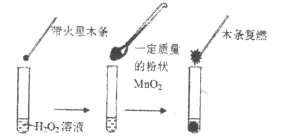
(1)甲同学欲用下图所示实验来证明![]() 是
是![]() 分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究![]() 的量对催化效果的影响,乙同学分别量取
的量对催化效果的影响,乙同学分别量取![]() 1%
1%![]() 加入容器中,在一定质量范围内,加入不同质量的
加入容器中,在一定质量范围内,加入不同质量的![]() ,测量所得气体体积,数据如下:
,测量所得气体体积,数据如下:
| 0.1 | 0.2 | 0.4 |
40s末 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析![]() 和
和![]() 对
对![]() 分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有
分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)①查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为![]() 分解反应的催化剂需要满足的条件是___________。
分解反应的催化剂需要满足的条件是___________。
【答案】 不能 因为没有确认![]() 的质量和化学性质是否改变 在一定质量范围内,
的质量和化学性质是否改变 在一定质量范围内, ![]() 质量越大,反应速率越快
质量越大,反应速率越快 ![]() 和
和![]() 对
对![]() 的分解均有催化作用,且
的分解均有催化作用,且![]() 比
比![]() 催化效果好 做对比实验,证明
催化效果好 做对比实验,证明![]() 对
对![]() 的分解没有催化作用
的分解没有催化作用 ![]()
![]()
![]() 分解反应的催化剂具有氧化性,且其氧化性强于
分解反应的催化剂具有氧化性,且其氧化性强于![]() ;催化剂被还原后所得物质又能被
;催化剂被还原后所得物质又能被![]() 氧化生成催化剂。
氧化生成催化剂。
【解析】(1)要证明MnO2是H2O2分解反应的催化剂,必须证明催化剂在反应前后的性质和质量不改变,而甲同学没有做这方面的实验,所以不能达到目的,故答案为:不能;因为没有确认MnO2的质量和性质是否改变;
(2)根据表格中数据,在一定质量范围内,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,原因是在一定质量范围内,固体质量越大,其表面积也越大,故反应速率加快,催化效果更好,故答案为:在一定质量范围内,MnO2质量越大,反应速率越快;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,故答案为:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl-对H2O2的分解没有催化作用;
(4)①根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl =2FeCl3+2H2O,故答案为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl、2FeCl2+H2O2+2HCl =2FeCl3+2H2O;
②二价锰、二价铁和一价铜都是化合价降低得到的,说明二氧化锰、Fe3+、Cu2+得到电子,作氧化剂,将双氧水氧化,还原得到的二价锰、二价铁和一价铜又被双氧水氧化成二氧化锰、Fe3+、Cu2+,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂,故答案为:H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,其基本合成过程如下:
2NH3(g) H<0合成氨,其基本合成过程如下:
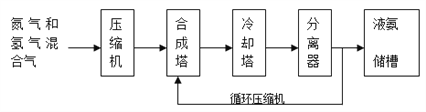
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(N2)=___________mol·L-1·min-1。
②相对a而言,b可能改变的条件是______________________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1~t2时刻c(H2)的变化曲线________。
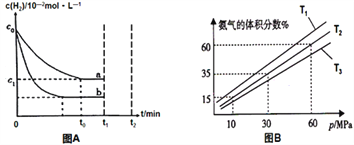
(2)某小组往一恒温恒压容器充入9 mol N2和23 mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
① 此时N2的平衡分压为__________MPa,H2的平衡分压为___________MPa。(分压=总压×物质的量分数)
② 列式计算此时的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧、得到CuO24.0g,若上述气体为NO和NO2的混合物,且体积比为1:2。则V可能为
A. 9.0 L B. 18.5L C. 25.7L D. 36.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的纯醋酸加水稀释,经实验测定溶液的导电能力变化如图所示,下列说法中正确的是
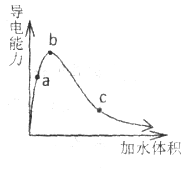
A. a、b、c三点溶液的pH: ![]()
B. a、b、c三点醋酸的电离程度: ![]()
C. 若用湿润的pH试纸测量a处的pH,测量结果偏小
D. 物质的量浓度分别为a、b、c三点的溶液各![]() ,用
,用![]() 氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
氢氧化钠溶液中和,消耗氢氧化钠溶液体积: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃按沸点由高到低顺序排列正确的是( )
①正丁烷②异丁烷③正戊烷④异戊烷⑤新戊烷
A.①②③④⑤B.⑤④③②①C.③①⑤④②D.③④⑤①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,化学性质最不活泼的是:_________(填具体元素符号,下同),②③⑤元素的原子半径由大到小的顺序为______________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________/span>,碱性最强的化合物的电子式是:______________________________。
(3) 最高价氧化物是两性氧化物的元素是____;写出该氧化物与氢氧化钠反应的离子方程式_____。
(4) 用电子式表示元素④与⑥的化合物的形成过程:______________,该化合物属于__________(填 “共价”或“离子”)化合物。
(5)写出①与③形成的化合物的电子式____、结构式为___,该化合物的晶体属于_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣═H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com