
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: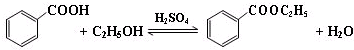
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
分析 (1)减少生成物能促进平衡向正反应方向移动;
(2)根据分水器中水位判断;
(3)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于212.6℃,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点;
(4)白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸;
(5)分流漏斗的使用方法,必须将水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇,而且放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下;
(6)蒸馏时所用的玻璃仪器有酒精灯、冷凝管、接收器、锥形瓶、蒸馏烧瓶、温度计,由此分析解答;
(7)实验的产率=$\frac{实际产量}{理论产量}×100%$.
解答 解:(1)分离器分离出生成的水,减少生成物从而使该反应向正反应方向移动,提高转化率;故答案为:分离产生的水,使平衡向正反应方向移动,提高转化率;(2)当该反应完成后,就不再生成水,则加热回流至分水器中水位不再上升,故答案为:分水器中的水层不再增加时,视为反应的终点;
(3)温度低于苯甲酸乙酯的沸点时,苯甲酸乙酯不被蒸馏出,要使苯甲酸乙酯不被蒸馏出,则温度应低于苯甲酸乙酯的沸点,所以温度应低于212.6℃,但要使乙醇和环己烷蒸馏出,所以温度应高于乙醇和环己烷的沸点80.8,故答案为:C;
(4)白烟是固体小颗粒,因为苯甲酸在100℃会迅速升华,所以可能是苯甲酸乙酯中混有未除净的苯甲酸,加热升华产生白烟,故答案为:苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;
(5)分流漏斗的使用方法,必须将水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇,而且放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔,只有这样液体才能顺利流下,故选:A D;
(6)蒸馏时所用的玻璃仪器有酒精灯、冷凝管、接收器、锥形瓶、蒸馏烧瓶、温度计,故答案为:蒸馏烧瓶,温度计;
(7)12.20g苯甲酸的物质的量为:$\frac{12.20g}{122g/mol}$=0.1mol,而生成苯甲酸乙酯的质量为:12.86mL×1.05g•ml-1=13.503g,物质的量为:$\frac{13.503g}{122g/mol}$=0.11mol,所以实验的产率=$\frac{实际产量}{理论产量}×100%$=$\frac{0.1}{0.11}$×100%=90%,故答案为:90%.
点评 本题考查了有机实验方案的设计,明确实验原理是解本题关键,注意反应结束的判断标志,为易错点.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现需90mL1.0mol/LNaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 | |
| B. | 测定溶液 pH的实验中,用润湿的pH试纸测定新制氯水的pH--测定结果偏高 | |
| C. | 中和热实验测定中,缓慢地将NaOH溶液倒入测定装置中--对测定结果无影响 | |
| D. | 酸碱中和滴定实验中,标准液滴定前无气泡而滴定后有气泡--测定结果偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com