
| 催化剂 |
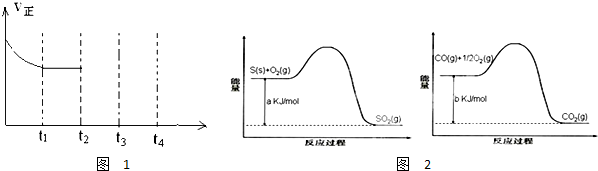
| 180℃ |
| 催化剂 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| 总重量 |
| 体积 |
| 总重量 |
| 总物质的量 |
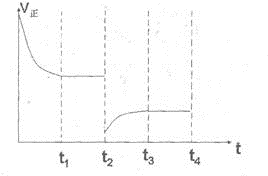 ,
, ;
;| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.8×0.8 |
| 0.2×1.2 |
| 1.6 |
| 4 |
| 0.4 |
| 2 |
| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.4×0.4 |
| 1.6×1.6 |
| 1 |
| 6 |
| 5×2 |
| 10×5 |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
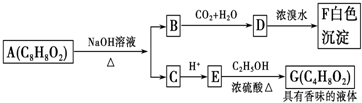
| A、根据图示可推知D为苯酚 |
| B、G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| C、上述各物质中能发生水解反应的有A、B、D、G |
| D、A的结构中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 →
→ +H2O
+H2O 、
、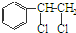 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去.
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
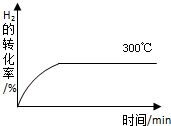 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
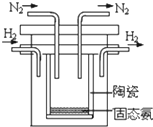 (1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com