
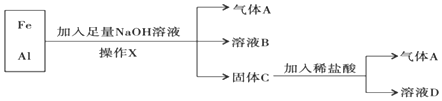
分析 由流程可知,Al与NaOH溶液反应生成偏铝酸钠和氢气,而Fe不能,则气体A为H2,溶液B含NaAlO2、NaOH,操作X为过滤,分离出固体C为Fe,Fe与稀盐酸反应生成氢气和氯化亚铁,则溶液D为FeCl2,以此来解答.
解答 解:(1)由上述分析可知,操作X分离不溶性固体与溶液,则名称为过滤,故答案为:过滤;
(2)由上述分析可知,气体A为H2,故答案为:H2;
(3)加入足量NaOH溶液时发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,加入稀盐酸发生反应的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2H+=Fe2++H2↑;
(4)溶液D为FeCl2,向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,该沉淀转化的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率的大小主要由浓度、温度、压强等外界因素决定 | |
| B. | 化石燃料是不可再生能源,生物质能是可再生能源 | |
| C. | 许多水果与花卉的芳香气味是因含有酯的原因 | |
| D. | 人工合成尿素,彻底动摇了“生命力论”,使有机化学迅猛发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、Cl- | B. | 肯定有Al3+、Mg2+、NH4+、Cl- | ||
| C. | 肯定有HCO3-、K+、MnO4- | D. | 肯定有Al3+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
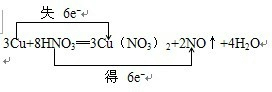 ,该反应中氧化剂是硝酸,氧化产物与还原产物的物质的量之比为3:2.
,该反应中氧化剂是硝酸,氧化产物与还原产物的物质的量之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
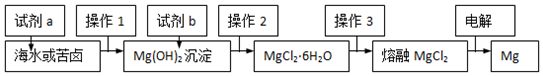
| A. | 流程中试剂a为NaOH溶液,试剂b为盐酸 | |
| B. | 操作2的具体方法是加热浓缩,冷却结晶 | |
| C. | 操作3是将晶体置于HCl气体氛围中脱水 | |
| D. | 电解MgCl2时,阳极生成Cl2,阴极生成Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可做自来水消毒剂 | B. | 碳酸钠可用于制造玻璃制造肥皂 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Na2O2用作潜水艇供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | 灼烧某物质时,用肉眼直接观察到火焰呈黄色,则可判断该物质一定含钠元素 | |
| C. | 将镁条放在空气中充分燃烧,可以得到三种固体 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液,则放出氢气的体积相等(同温同压下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者均有丁达尔效应 | B. | 两者均能透过半透膜 | ||
| C. | 分散质粒子可通过滤纸 | D. | 加入盐酸先沉淀,随后溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com