
【题目】某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
(1)该反应的化学方程式为:_____________________;
(2)反应开始至2min,用X表示的平均反应速率为____________________________;
(3)反应开始至2min时,Y的转化率为__________;
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)?
①降低温度:________
②保持容器的体积不变,增加X的物质的量:________;
③保持容器的体积不变,增加He:________;
④增大容器的体积:________。
(5)下列叙述能说明上述反应一定达到化学平衡状态的是______(填序号)
A.X、Y、Z的物质的量之比为3:1:2
B.X、Y、Z的浓度不再发生变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.容器中的压强不再发生变化
【答案】Y+3X2Z 0.075mol·L-1·min-1 10% 减小 增大 不变 减小 B、E
【解析】
(1)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,可写出化学方程式;(2)根据![]() 计算用X表示的平均反应速率;(3)转化率=变化量
计算用X表示的平均反应速率;(3)转化率=变化量![]() 初始量
初始量![]() 100%;(4)根据影响反应速率的因素分析;(5)根据化学平衡的定义及由定义延伸出的变量不变是平衡状态分析。
100%;(4)根据影响反应速率的因素分析;(5)根据化学平衡的定义及由定义延伸出的变量不变是平衡状态分析。
(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,所以反应方程式是3X+Y![]() 2Z;(2)反应开始至2min,△n(X)=0.3mol,△c(X)=0.3mol
2Z;(2)反应开始至2min,△n(X)=0.3mol,△c(X)=0.3mol![]() 2L=0.15 mol·L-1,用X表示的平均反应速率
2L=0.15 mol·L-1,用X表示的平均反应速率![]() 0.075mol·L-1·min-1;(3)转化率=变化量
0.075mol·L-1·min-1;(3)转化率=变化量![]() 初始量
初始量![]() 100%=(1-0.9)
100%=(1-0.9) ![]() 1
1![]() 100%=10%; (4)①降低温度反应速率一定减小;②保持容器的体积不变,增加X的物质的量,X的浓度增大,反应速率增大;③保持容器的体积不变,增加He,反应物的浓度不变,反应速率不变;④增大容器的体积,反应物的浓度减小,反应速率减小;(5)X、Y、Z的物质的量之比为3:1:2,不能确定是否还发生变化,故不一定平衡,不选A;根据化学平衡定义, X、Y、Z的浓度不再发生变化,一定平衡,选B;单位时间内每消耗3molX,同时生成2molZ,都是指正反应速率,不能说明正逆反应速率相等,故不一定平衡,不选C;反应前后全是气体,混合气体的总质量是恒量,混合气体的总质量不随时间的变化而变化,不一定平衡,不选D;反应在固定容积的容器中进行,反应前后气体物质的量是变量,所以压强是变量,容器中的压强不再发生变化一定平衡,故选E。
100%=10%; (4)①降低温度反应速率一定减小;②保持容器的体积不变,增加X的物质的量,X的浓度增大,反应速率增大;③保持容器的体积不变,增加He,反应物的浓度不变,反应速率不变;④增大容器的体积,反应物的浓度减小,反应速率减小;(5)X、Y、Z的物质的量之比为3:1:2,不能确定是否还发生变化,故不一定平衡,不选A;根据化学平衡定义, X、Y、Z的浓度不再发生变化,一定平衡,选B;单位时间内每消耗3molX,同时生成2molZ,都是指正反应速率,不能说明正逆反应速率相等,故不一定平衡,不选C;反应前后全是气体,混合气体的总质量是恒量,混合气体的总质量不随时间的变化而变化,不一定平衡,不选D;反应在固定容积的容器中进行,反应前后气体物质的量是变量,所以压强是变量,容器中的压强不再发生变化一定平衡,故选E。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2 ![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(1),△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释物质用途或现象的反应方程式不准确的是
A. 硫酸型酸雨的形成会涉及反应2H2SO3+O2![]() 2H2SO4
2H2SO4
B. 工业上制取粗硅的化学方程式:SiO2+C![]() Si+CO2↑
Si+CO2↑
C. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2+S↓+H2O
D. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用化学试剂,工业上常以软锰矿(主要成分是MnO2)为原料进行制备,主要工艺流程如下图:
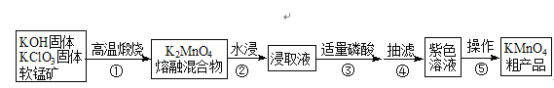
已知:3K2MnO4+2H3PO4═2KMnO4+MnO2↓+2K2HPO4+2H2O
物质 | KMnO4 | K2HPO4 | K2SO4 | CH3COOK | KCl | K2CO3 |
293K溶解度/g | 6.4 | 150 | 11.1 | 217 | 34 | 111 |
(1)原料高温煅烧时选用铁坩埚和铁棒,理由是__________。
(2)①中每生成1molK2MnO4时电子转移2mol,写出化学反应方程式_________。
(3)从反应机理和产物分离角度考虑,③可用磷酸,也可用下列________试剂。
A.醋酸 B.盐酸 C.硫酸 D.CO2
(4)下列描述不正确的是_________。
A.操作⑤中蒸发至大量晶体析出再冷却晶体,趁热过滤
B.抽滤时布氏漏斗中选用大小略小于漏斗内径且盖住全部小孔的滤纸
C.可用无水乙醇洗涤产品提高纯度
D.KMnO4晶体的烘干温度过高会降低产率
(5)粗产品的洗涤步骤可能需要用到以下操作:a.加入洗涤剂至浸没固体;b.洗涤剂缓慢通过;c.洗涤剂快速通过;d.关小水龙头;e.开大水龙头;f.重复2~3次。
请选出正确的操作并排序________。(操作可重复使用)
(6)高锰酸钾产品的纯度测定:准确称取0.7900g产品,配成250mL溶液,量取25.00mL于锥形瓶中,用0.1000molL﹣1(NH4)2Fe(SO4)2标准溶液进行滴定,滴定终点的现象__________。滴定前和滴定后的液面见下图。计算出高锰酸钾的纯度为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,发生3A(g)+B(g) ![]() 2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol, A的平均反应速率为0.12mol·L﹣1·s﹣1,则10s后容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+请回答下列问题:

(1)该装置中电解质溶液一定含有_______ (填序号)
A. Cu2+ B.Na+ C.Fe2+ D. Ag+
(2)若该装置是原电池,则b极为_______ 极(填“正”或“负”);a极的电极材料可以是________;该电池反应的总反应方程式是____________________。
若该装置是电解池,则a极为______ 极(填“阳”或“阴”); 当a极的质量增加6.4g时,电路上通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4ClO4可用作火箭燃料,130℃时会分解产生三种单质气体和水。实验室中通过NaClO4与NH4Cl反应来制取NH4ClO4,NH4ClO4与NaCl的溶解度如下图。下列说法正确的是( )

A. NH4ClO4分解后产生的气体通入紫色石蕊溶液中,溶液变红色
B. NH4ClO4分解后产生的气体通过足量NaOH溶液,再通过足量灼烧的铜网,可得到纯净的单质气体
C. NH4ClO4与NaCl的混合溶液分离时,应采取蒸发浓缩,冷却结晶,过滤,得到NH4ClO4固体粗产品
D. 在NH4ClO4固体粗产品中加入NaOH浓溶液,加热,收集所得NH3体积,可计算粗产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝 |
②中溶液产生胶状沉淀 | |
③中生成沉淀 | |
④中产生黄绿色气体 |
下列分析不正确的是
A. ①中溶液变蓝,体现了浓盐酸的氧化性
B. ②中产生白色胶状沉淀:2H++SiO32-=H2SiO3
C. ③中产生沉淀的原因可用平衡移动原理解释
D. ④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)![]()
![]()
![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)右图表示NO2的变化的曲线是_______。用O2表示从0~2 s内该反应的平均速率v=_______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com