
【题目】世界某著名学术刊物近期介绍了一种新型中温全瓷铁一空气电池,其结构如图所示。
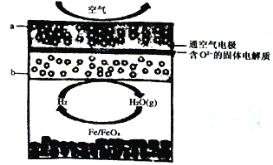
下列有关该电池放电时的说法正确的是( )
A.O2-由b极移向a极
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4L(标准状况)空气参与反应,则电路中有4mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
【答案】D
【解析】
由新型中温全瓷铁--空气电池的装置图可知,a极通入空气,空气中氧气得电子发生还原反应为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应为负极,结合原电池原理分析解答。
A、原电池中,阴离子向负极移动,O2-由正极移向负极,即a极移向b极,故A错误;
B、a极空气中氧气得电子发生还原反应为正极,电极反应式为:O2+4e-═2O2-,故B错误;
C、标准状况下,22.4L空气的物质的量为1mol,则参与反应的氧气为0.2mol,则电路中转移0.8mol电子,故C错误;
D、由新型中温全瓷铁--空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe═FeOx+xH2,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸来测定某![]() 溶液的浓度,甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
溶液的浓度,甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管未用标准盐酸润洗
B.开始时酸式滴定管尖嘴部分有气泡,滴定后气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛![]() 溶液的锥形瓶滴定前用
溶液的锥形瓶滴定前用![]() 溶液润洗2~3次
溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙醚和乙醇互为同分异构体
B.苯与苯乙烯具有相同最简式但不是同系物
C.![]() 分子中最多可以有20个原子共平面
分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3和C(CH3)4互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
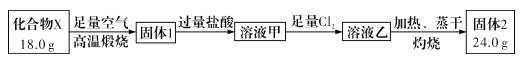
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
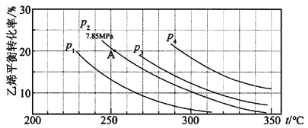
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.25 ℃水的电离常数是1.0×10-12
B.中性溶液的c(H+)=![]()
C.纯水在100 ℃时,c(H+)>10-7 mol·L-1,所以此时纯水中c(H+)>c(OH-)
D.pH<7的溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是( )

A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阳极区,在氢化酶作用下发生反应H2+2MV2+=2H++2MV+
C.正极区,在固氮酶催化作用下发生反应N2+6MV++6H2O=2NH3+6MV2++6OH-
D.电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com