
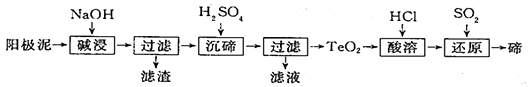
分析 根据TeO2微溶于水,易溶于较浓的强酸和强喊,加碱溶过滤除去杂质,得到Na2TeO3溶液,再加硫酸沉降经过滤得到TeO2沉淀,再用盐酸溶解生成四氯化碲,再用二氧化硫还原制成碲单质,
(1)TeO2微溶于水,易溶于较浓的强酸和强喊,是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应;
(2)Ag溶于稀硝酸生成硝酸银和NO;
(3)因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;
(4)SO2还原TeCl4为Te,本身被氧化为硫酸,根据得失电子守恒书写;
(5)①亚碲酸(H2TeO3)是二元弱酸分步电离,0.1mol•L-1H2TeO3的电离度 a可以依据第一步电离计算;
②A.NaHTeO3的溶液中存在电离和水解平衡,比较水解平衡常数和K2,得到电离与水解程度的相对大小,再比较微粒浓度;
B.根据电荷守恒:c(Na+)+c( H+)=c(HTeO3-)+2c(TeO32-)+c(OH-);
C.根据物料守恒:c(Na+)=c(TeO32-)+c( HTeO3-)+c( H2TeO3)
D.质子守恒:c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-).
解答 解:(1)TeO2微溶于水,易溶于较浓的强酸和强喊,是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,离子方程式为:TeO2+2OH-=TeO32-+H2O;
故答案为:TeO2+2OH-=TeO32-+H2O;
(2)碱浸后的“滤渣”为Ag和Au,Ag溶于稀硝酸,反应为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;
故答案为:3Ag+4HNO3=3AgNO3+NO↑+2H2O;
(3)因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;防止局部酸度过大的操作方法是:缓慢加入H2SO4,并不断搅拌;
故答案为:溶液酸性过强,TeO2会继续与酸反应导致碲元素损失;缓慢加入H2SO4,并不断搅拌;
(4)SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4;
故答案为:TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4;
(5)①25℃时,亚碲酸(H2TeO3)的 Ka1=1×10-3,K2=2×10-8,H2TeO3?H++HTeO3-,Ka1=$\frac{c({H}^{+})•c(HTe{{O}_{3}}^{-})}{c({H}_{2}Te{O}_{3})}$=$\frac{{c}^{2}({H}^{+})}{0.1}$=10-3,c(H+)=10-2mol/L,0.1mol•L-1H2TeO3的电离度 a 约为:$\frac{1{0}^{-2}}{0.1}$×100%=10%;
故答案为:10%;
②A.NaHTeO3的溶液中存在电离和水解平衡,水解平衡常数Kh=$\frac{c(O{H}^{-})•c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$=$\frac{c(O{H}^{-})•c({H}_{2}Te{O}_{3})}{c(HTe{{O}_{3}}^{-})}$$•\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{Ka1}$=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11<K2=2×10-8,说明HTeO3-水解程度小于其电离程度,溶液显酸性,则c(Na+)>c(HTeO3-)>c(H+)>c(H2TeO3)>c(OH-),故A错误;
B.根据电荷守恒:c(Na+)+c( H+)=c(HTeO3-)+2c(TeO32-)+c(OH-),故B错误;
C.根据物料守恒:c(Na+)=c(TeO32-)+c( HTeO3-)+c( H2TeO3),故C正确;
D.质子守恒:c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-),故D正确;
故答案为:C D.
点评 本题考查粗铜精炼的电解反应式的书写,对给定条件的化学方程式、离子方程式的判断及书写、电离平衡常数的应用、溶液中离子浓度大小的判断等,难点是NaHTeO3的溶液中电离和水解平衡程度的相对大小,注意化学原理的掌握和应用,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:X<Y<Z<W | |
| B. | 元素的非金属性:Y>W>X | |
| C. | t中只含离子键 | |
| D. | v能抑制水的电离而u能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13.工业上制备r和q的反应如图.下列说法正确的是( )| A. | W、与X、Y、Z形成的化合物均是共价化合物 | |
| B. | 简单离子半径:Z>Y>X | |
| C. | X、Y、Z形成的化合物水溶液一定呈碱性 | |
| D. | X、Y形成的化合物一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
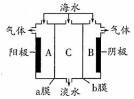 海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示.下列说法正确的是( )
海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示.下列说法正确的是( )| A. | b膜是阳离子交换膜 | |
| B. | A极室产生气泡并伴有少量沉淀生成 | |
| C. | 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC | |
| D. | B极室产生的气体可使湿润的KI淀粉试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、AlO2-、CO32- | B. | K+、Ba2+、SO42- | C. | NH4+、OH-、NO3- | D. | Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
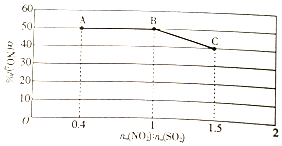 已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).
已知NO2与以SO2能发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
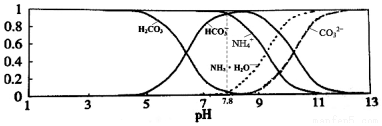
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | 往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 通过分析可知常温下Kb(NH3•H2O)>Ka1(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com