
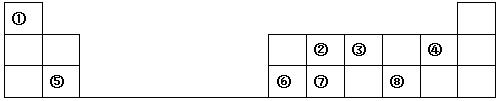
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.分析 ①由图可知,反应物总能量大于生成物总能量,为放热反应;
②焓变等于正逆反应的活化能之差;
③催化剂不改变反应的始终态,降低反应所需的活化能.
解答 解:①由图可知,反应物总能量大于生成物总能量,为放热反应,则该反应的△H=E2-E1,故答案为:E2-E1;
②焓变等于正逆反应的活化能之差,△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能为167.2kJ•mol-1-(-241.8kJ•mol-1)=409.0kJ•mol-1,
故答案为:409.0kJ•mol-1;
③催化剂不改变反应的始终态,降低反应所需的活化能,由图可知,虚线( II)与实线( I)相比,活化能减小,因此反应速率增大,最可能的原因是使用了催化剂,
故答案为:使用了催化剂.
点评 本题考查反应热与焓变,为高频考点,把握图中能量变化、焓变与活化能的关系为解答的关键,侧重分析与应用能力的考查,注意催化剂对活化能的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | N2完全转化为NH3时,即可视为达到化学平衡状态 | |
| B. | 达到化学平衡时,容器内压强和气体密度都不再变化 | |
| C. | 达到化学平衡时,反应则停止进行 | |
| D. | 达到化学平衡时,3ν(逆NH3)=2ν(正H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2→CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH→CH3CH=CH2+NaCl+H2O | |
| D. |  -Cl+H2O→ -Cl+H2O→ -OH+HCl -OH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(NH4+)相同的溶液中,溶质的物质的量浓度:c(NH3•H2O)>c(CH3COONH4)>c(NH4Cl)>c(NH4HSO4) | |
| B. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量盐酸大于醋酸 | |
| D. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 高温条件能杀死H7N9禽流感病毒,是因为病毒的蛋白质受热变性 | |
| C. | 为消除碘缺乏症,卫生部规定必须在食盐中加单质碘 | |
| D. | 油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| B. | 向含1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时的反应:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加少量的稀盐酸:6Br-+2NO3-+8H+=3Br2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
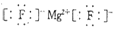 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com