
| A. | 1mL pH=2 的醋酸溶液加水稀释到10mL,pH 变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH 溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl 溶液稀释过程中,c(NH4+)与c(NH3•H2O)之和始终保持不变 |
分析 A.醋酸是弱电解质加水稀释促进电离;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移;
C.根据电荷守恒分析;
D.NH4Cl溶液稀释过程中浓度减小.
解答 解:A.醋酸是弱电解质加水稀释促进电离,溶液中氢离子的物质的量增大,所以1mL pH=2的醋酸溶液加水稀释到10mL,pH<3,故A错误;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移,HCO3-的物质的量增大,CO32-的物质的量减小,则碳酸氢根和碳酸根离子浓度比值增大,故B正确;
C.向氯水中加入少量NaOH溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),由于溶液显酸性,c(H+)>c(OH-),则c(Na+)<c(Cl-)+c(ClO-),故C错误;
D.NH4Cl溶液稀释过程中浓度减小,则c(NH4+)与c(NH3•H2O)之和逐渐减小,故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡和盐的水解平衡的应用,难度不大,化学平衡移动原理同样适合水解平衡的移动,要多迁移,多联系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
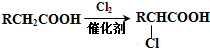
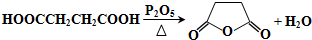
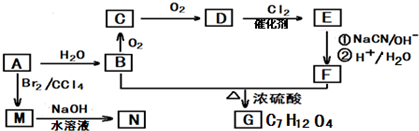
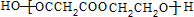 +(2n-1)H2O.
+(2n-1)H2O.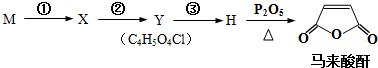
| 序号 | 所加试剂及条件 | 反应类型 |
| ② | ||
| ③ | , |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
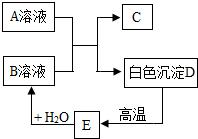 A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:
A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g/mol | B. | 78g/mol | C. | 106g/mol | D. | 88g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
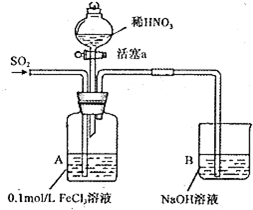
| 实验 序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液. | 加人KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A 中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| V | 取出少量A装置中的溶液,加入KSCN 溶液. | 溶液变为红色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com