
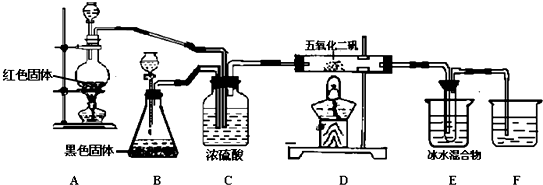
 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:分析 本实验目的是制备次氯酸钠,根据实验装置可知,首先制备氯气,甲装置中发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,因氯化氢易挥发,所以制得的氯气中含有氯化氢、水,HCl气体进入丁装置中,消耗NaOH,降低NaClO的含量,所以通过B装置将氯气中的HCl除去,装置丙:除去氯气中的水蒸气.要提高次氯酸钠的含量,根据题意可知应在较低温度下反应,否则如温度过高则易生成NaClO3,丁装置中:冰水的作用防止Cl2与NaOH溶液在温度较高时,发生其他反应,低温下氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,制得次氯酸钠.
(1)依据图中仪器特点结合反应流程分析,烧瓶B中盛MnO2,大试管C中盛NaOH溶液;
(2)烧瓶B中二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水,试管C中氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)①氯化氢不除,氯化氢和氢氧化钠反应生成氯化钠和水会消耗NaOH,降低NaClO的含量;②氯气与氢氧化钠反应在溶液中进行,无需用丙装置除去氯气中的水.
解答 解:甲装置中发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,乙装置中:用饱和的氯化钠溶液除去氯气中的氯化氢,装置丙中:用浓硫酸除去氯气中的水蒸气,丁装置中:冰水的作用防止Cl2与NaOH溶液在温度较高时,发生其他反应,试管C中氯气和氢氧化钠反应:Cl2+2NaOH═NaCl+NaClO+H2O.
(1)根据实验装置可知,首先制备氯气,发生反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,则A中盛放浓盐酸,B中盛放MnO2,氯气和NaOH反应生成次氯酸钠,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯气经除杂后在C中和NaOH反应生成次氯酸钠,
故答案为:MnO2;NaOH溶液;
(2)烧瓶B中二氧化锰和浓盐酸发生氧化还原反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,试管C中氯气和氢氧化钠反应:Cl2+2NaOH═NaCl+NaClO+H2O,其离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2OH-═Cl-+ClO-+H2O;
(3)①乙装置不能省略,可用来除去HCl,否则氯化氢和氢氧化钠反应生成氯化钠和水会消耗NaOH,降低NaClO的含量,
故答案为:不能;会降低NaClO的含量;
②氯气与氢氧化钠溶液反应生成次氯酸钠,反应在溶液中进行,则没有必要除去氯气中的水蒸气,故答案为:能;NaOH溶液中含有水.
点评 本题考查氯气的实验室制法和氯气的化学性质,题目难度中等,注意把握实验的目的和反应原理,此为解答实验题的关键,注意题中图示信息.


科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | (5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4Cl在溶液通电时可以电离 | |
| B. | Al(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应 | |
| D. | Al(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | b>f | |
| B. | 平衡常数K(1000℃)<K(810℃) | |
| C. | 915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa | |
| D. | 1000℃,3.0MPa时E的转化率为83% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com