
| 1.92g |
| 64g/mol |
| 1.92g |
| 64g/mol |
| 3 |
| 8 |
| 0.0225mol |
| 0.1L |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、常温下,在18g18O2中含有NA个氧原子 |
| B、标准状况下,17g NH3所含共价键数为NA个 |
| C、标准状况下,22.4L苯的分子数约为NA个 |
| D、1mol Na2O2中含有的阴离子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.044mol/L |
| B、0.44mol/L |
| C、4.4mol/L |
| D、44mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
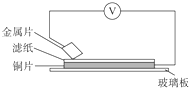 将洁净的铁片和其他金属片A、B、C、D分别放在浸有NaCl溶液的滤纸上并压紧(如图所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的铁片和其他金属片A、B、C、D分别放在浸有NaCl溶液的滤纸上并压紧(如图所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 指针移动方向 | 电压 | |
| ① | Fe | (-) | 0.65 |
| ② | A | (-) | 0.78 |
| ③ | B | (+) | 0.25 |
| ④ | C | (-) | 1.35 |
| ⑤ | D | (-) | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com