
 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:分析 A、B、C、D、E、F六种元素的原子序数依次增大.其中B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为碳元素;A的最高正价和最低负价的绝对值相等,原子序数大于碳,故A为H元素;E的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素,故E为Mg,而C的原子序数介于碳、氧之间,则C为N元素;F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故F为Ni,据此解答.
解答 解:A、B、C、D、E、F六种元素的原子序数依次增大.其中B的基态原子有3个不同的能级,且各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故B为碳元素;A的最高正价和最低负价的绝对值相等,原子序数大于碳,故A为H元素;E的基态原子的s能级的电子总数与p能级的电子数相等,原子核外电子排布式为1s22s22p4或1s22s22p63s2,D的基态原子与B的基态原子的未成对电子数目相同,D的原子序数小于E,原子核外电子排布只能为1s22s22p4,则D为O元素,故E为Mg,而C的原子序数介于碳、氧之间,则C为N元素;F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,故原子核外电子排布为1s22s22p63s23p63d84s2,故F为Ni,
(1)F的基态原子的3d轨道电子数是4s电子数的4倍,4s电子只能有2个电子层,3d能级有8个电子,故原子核外电子排布为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)C、N、O、Mg四种元素,Mg属于金属,第一电离能最小,C、N、O同周期,随原子序数增大的第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为Mg<C<O<N,
故答案为:Mg<C<O<N;
(3)A.C2H2分子中含有C≡C三键、C-H键,含有σ键和π键,而H2O2分子为H-O-O-H,只含有σ键,故A错误;
B.C2H2分子中C原子成2个σ键、没有孤对电子,杂化轨道数目为2,采取sp杂化,H2O2分子中O原子成2个σ键、含有2对孤电子对,杂化轨道数目为4,采取sp3杂化,故B错误;
C.C2H2是直线型对称结构,是非极性分子,而H2O2分子是展开书页形结构,属于极性分子,故C错误;
D.C2H2分子、H2O2分子含有电子总数或价电子总数不相等,不是等电子体,故D错误;
E.C2H2常温下为气态,而H2O2常温下为液态,故E正确,
故选答案为:E;
(4)Ni2+能与CO分子通过配位键形成[Ni(CO)4]2+,其原因是CO分子中含有孤电子对,故答案为:孤电子对;
(5)C的多种同素异形体中,熔点最高的两种物质是金刚石和石墨,金刚石熔点高于石墨,金刚石是原子晶体而石墨是混合型晶体,故答案为:金刚石;石墨;金刚石是原子晶体而石墨是混合型晶体;
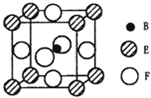
(6)以上底面面心F原子研究,与之距离最近的F原子位于晶胞两个侧面及前后面面心上,而晶胞上底面为上层晶胞的下底面,故与之最近的F原子有8个;
由晶胞晶胞可知,晶胞中C原子数目=1、Ni元素数目=6×$\frac{1}{2}$=3、Mg原子数目=8×$\frac{1}{8}$=1,故该晶体的化学式为MgNi3C;
晶胞质量=$\frac{M}{{N}_{A}}$g,上底面对角线长度=(2r2+2r3)pm=(2r2+2r3)×10-10cm,故晶胞棱长=$\frac{\sqrt{2}}{2}$×(2r2+2r3)×10-10cm=$\sqrt{2}$(r2+r3)×10-10cm,晶胞体积=[$\sqrt{2}$(r2+r3)×10-10cm]3=2$\sqrt{2}$(r2+r3)3×10-30cm3,故晶胞密度=$\frac{\frac{M}{{N}_{A}}g}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}×1{0}^{-30}c{m}^{3}}$g.cm-3=$\frac{1{0}^{3}M}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}•{N}_{A}}$g.cm-3,
故答案为:8;MgNi3C;$\frac{1{0}^{3}M}{2\sqrt{2}({r}_{2}+{r}_{3})^{3}•{N}_{A}}$.
点评 本题考查物质结构与性质,涉及核外电子排布、电离能、分子结构与性质、配合物、晶胞结构与计算等,学生要熟练掌握基础知识,并能迁移运用,(6)中晶胞结构与计算,为易错点,需要学生具有一定的空间想象与数学计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

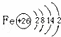 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸能发生酯化反应,只要一种反应物过量酯化反应就能进行彻底 | |
| B. | 把乙烯通入溴水中,溴水立即褪色,这是由于乙烯具有漂白性 | |
| C. | 煤的气化和煤的干馏都发生了化学变化,而石油的分馏属于物理变化 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ②③ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层电子数是K层电子数的3倍 |
| X | 一种同位素可测定文物年代 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,C(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①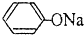 溶液②CH3COONa溶液中的c(Na+):①>② 溶液②CH3COONa溶液中的c(Na+):①>② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com