
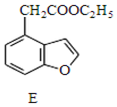
 写出同时满足下列条件的E的一种同分异构的结构简式:
写出同时满足下列条件的E的一种同分异构的结构简式: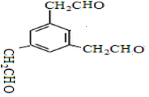
科目:高中化学 来源: 题型:选择题
| A. | Ca2+,Na+,NO3-,Cl- | B. | K+,Ba2+,Cl-,NO3- | ||
| C. | Na+,HCO3-,CO32-,K+ | D. | Na+,Cl-,K+,MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
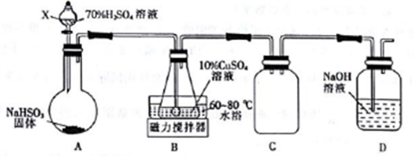
| 实验操作 | 预期现象及结论 |
| 取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则①II(填“I”“II”或“III”,下同)成立,若没有气泡产生,则②I或III成立 |
| 另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡 | ③溶液变为蓝色,则III成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
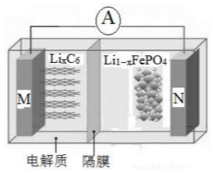 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )| A. | 放电时Li+从右边移向左边 | |
| B. | 放电时M是负极,电极反应式为:C6x--xe-═6C | |
| C. | 充电时电路中通过0.5mol电子,消耗36gC | |
| D. | 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-═Li1-xFeO4+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液与Ba(OH)2溶液混合 | B. | NH3•H2O溶液与HCl溶液混合 | ||
| C. | NaHCO3溶液与NaOH溶液混合 | D. | HNO3溶液与KOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
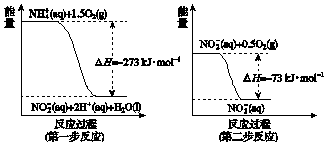
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com