
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。回答下列问题:
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
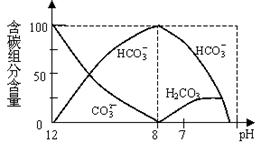 ②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh

 2×10-4,当溶液中c(HCO3-)︰c(CO32-)
2×10-4,当溶液中c(HCO3-)︰c(CO32-) 2︰1时,溶液的pH
2︰1时,溶液的pH 。
。
科目:高中化学 来源: 题型:
锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ 锂的原子结构示意图为 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色。生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂。写出生成氮化锂的化学方程式 。锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物 (填化学式)。
Ⅱ 下面是从锂辉石(Li2O·Al2O3·SiO2)中提出锂的工业流程示意图。
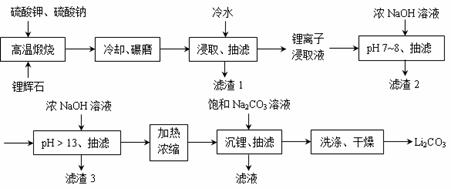
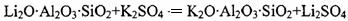 ①高温煅烧时的反应原理为:
①高温煅烧时的反应原理为:
 |
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是 。
(2)滤渣2的主要成分为 。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是 ,用离子方程式表示其产生的原因 。
(4)加热浓缩的作用是 。
(5)洗涤Li2CO3晶体使用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
 A.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中
A.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中
发生倒吸现象
B.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,
再加冰醋酸
C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D.试管b中Na2CO3的作 用
用 是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度
是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,在所给条件下一定能大量共存的是 ( )
A. pH=0 的溶液中:Mg2+、Fe3+ 、NO3- 、SO42-
B. 能和Ca2+生成沉淀的溶液中:Ba2+、K+ 、CH3COO-、Cl-
C. 能使碘化钾淀粉试纸变蓝的溶液:Na+ 、NH4+、S2-、SO32-
D. 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3- 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
今有:①纯净的碳酸钠ag;②碳酸钠与碳酸氢钠的混合物ag.两者相比,下列各种情况的描述正确的是()
| A. | 分别和盐酸完全反应时,混合物的耗酸量多 | |
| B. | 分别和盐酸完全反应时,纯净的碳酸钠放出的CO2多 | |
| C. | 分别溶于水,再加入足量澄清石灰水,混合物得到的沉淀质量大 | |
| D. | 分别配成等体积的溶液,混合物溶液的Na+的物质的量浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是 ( )
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质
分子数大于2 NA
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02 NA (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com