
下列反应,其产物的颜色按红色、红褐、淡黄、蓝色顺序排列的是
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液 ④无水CuSO4放入医用酒精中
A.①②③④ B.③④①② C.③②①④ D.②①④③
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017年陕西西藏民族学院附中高二12月月考化学卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上月考四化学卷(解析版) 题型:填空题
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上月考四化学卷(解析版) 题型:选择题
下列说法正确的是
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其他条件不变时,升高温度可以使化学平衡向吸热反应方向移动
D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一12月月考化学卷(解析版) 题型:推断题
A、B、C、X是中学化学中常见的物质,它们之间的转化关系加下图所示(部分产物已略去)。请回答下列问题:
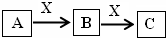
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色的气体。A转化为B的化学方程为 ,
请写出实验室制取A的化学方程式: 。
(2)若B是一种常见的温室气体,则B转化为C的化学方程式 。
(3)若X是金属单质,向B、C溶液中分别滴加AgNO3溶液,均产生不溶于稀硝酸的白色沉淀,则B的化学式为 。保存C溶液常加入少量X,其目的是 ,请写出B转化为C的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一12月月考化学卷(解析版) 题型:选择题
下列关于氧化还原反应的叙述,正确的是
A.有一种元素得电子,肯定有另一种元素失电子
B.在反应中不一定所有元素的化合价都发生变化
C.某元素由化合态变为游离态,则该元素一定得电子
D.氧化还原反应中不一定有电子的转移
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一12月月考化学卷(解析版) 题型:填空题
利用生产钛白的副产品绿矾(FeSO4•7 H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要
H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要 反应有:
反应有:
FeCO3 FeO+CO2,
FeO+CO2,
C+CO2 2CO,
2CO,
CO+FeO Fe+CO2,
Fe+CO2,
(1)检验绿矾是否已有部分氧化的方法是 。
(2)证明沉淀已经洗涤干净的方法是 。
(3)干燥过程中少量FeCO3•nH2O被氧化为FeOOH,反应方程式为: 。
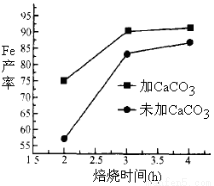
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,上图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏林芝一中高一上期末化学试卷(解析版) 题型:实验题

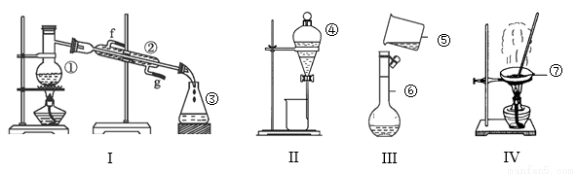
(1)写出下列仪器的名称:③ ,④ ,⑦ 。
(2)以上装置中,不能进行物质的分离与提纯实验的是 (填写相应序号,下同);实验装置不完整的是 ;加热时需加垫石棉网的是 ;实验之前需检查装置气密性的是 。
(3)实验室准备用18 mol/L浓硫酸配制100 mL 3 mol/L稀硫酸。则所需浓硫酸的体积是________ mL(保留一位小数),量取浓硫酸所用量筒的规格是________(选填“10mL”、“25mL”或“50mL”)。在实验操作的摇匀过程中,不慎洒出几滴,此时应采取的措施是 。解决了上述问题后,仍发现所配制的稀硫酸浓度偏大,则下列可能的原因分析中正确的是 。
A.配制前,容量瓶中有少量蒸馏水 |
B.量取浓硫酸时,仰视液体的凹液面 |
C.未经冷却,立即转移至容量瓶定容 |
D.定容时,俯视溶液的凹液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com