
科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
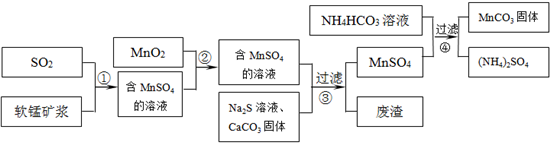
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
查看答案和解析>>
科目:高中化学 来源:常州三模 题型:问答题
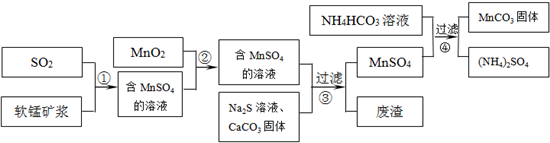
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(08广东实验中学三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
 |
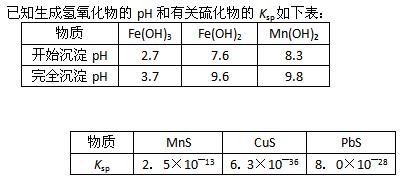
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42― + 4H+
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”)该流程可与__(填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 ,这样设计的目的和原理是
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
((5)软锰矿中锰的浸出有两种工艺:工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰州二中高三(上)第一次月考化学试卷(解析版) 题型:解答题
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com