

| A. | IO${\;}_{4}^{-}$作氧化剂 | |
| B. | 氧化性:Mn2+>IO${\;}_{3}^{-}$ | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 若有2mol Mn2+参加反应,则转移10mol电子 |
分析 已知锰离子是反应物,反应后生成高锰酸根离子,则锰离子失电子作还原剂,含有碘元素的离子在反应中作氧化剂,碘元素应该得电子化合价降低,所以IO4-是反应物,IO3-是生成物,根据元素守恒知,水是反应物,该反应方程式为:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,据此进行解答.
解答 解:根据氧化还原反应知该反应方程式为:2 Mn2++5 IO4-+3H2O=2MnO4-+5IO3-+6H+,
A.IO4-在反应中得电子作氧化剂,故A正确;
B.该反应中Mn2+为还原剂,IO3-为还原产物,则还原性Mn2+>5IO3-,故B错误;
C.氧化剂和还原剂的物质的量之比为5:2,故C正确;
D.若有2mol Mn2+参加反应时则转移=2mol×(7-2)=10mol电子,故D正确;
故选B.
点评 本题考查氧化还原反应及计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意从化合价的角度解答该题,难度不大.


科目:高中化学 来源: 题型:实验题
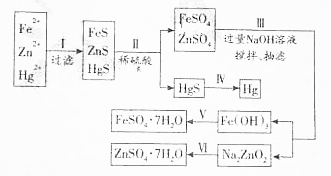
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO${\;}_{4}^{2-}$+4H+ | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向明矾溶液中滴加过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO${\;}_{3}^{-}$+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
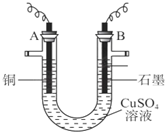
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
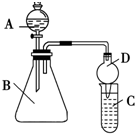 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
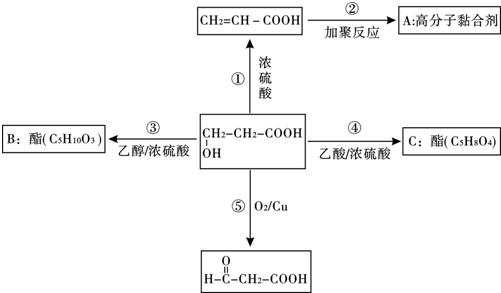
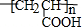 ,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.
,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com