
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 煤的干馏和气化都是物理变化 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
分析 A、在溶液中或熔融状态下能自身电离出自由移动的离子而导电的化合物为电解质;
B、将煤隔绝空气加强热使其分解的过程为煤的干馏;煤的气化是用煤来生产水煤气;
C、水玻璃是硅酸钠的水溶液;
D、合金的密度一般比其成分金属小,强度比其成分金属大.
解答 解:A、在溶液中或熔融状态下能自身电离出自由移动的离子而导电的化合物为电解质,而三氧化硫溶于水后不是其本身电离出离子而导电的,故为非电解质,故A错误;
B、将煤隔绝空气加强热使其分解的过程为煤的干馏,故为化学变化;煤的气化是用煤来生产水煤气,故也为化学变化,故B错误;
C、氯水、氨水和王水均为混合物,水银即单质汞,故为纯净物,但水玻璃是硅酸钠的水溶液,故为混合物,故C错误;
D、合金的密度一般比其成分金属小,强度比其成分金属大,故铝合金的密度比铝更小,强度比铝大,且抗腐蚀能力强,故D正确.
故选D.
点评 本题考查了电解质、非电解质的判断、煤的综合利用的原理和合金的性能,难度不大,应注意的是电解质和非电解质必须均为化合物.


科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 单质是一种淡黄色固体,是黑火药成分之一 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
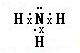 ,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
,其水溶液呈碱性的原因是(用电离方程式表示):NH3•H2O?NH4++OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
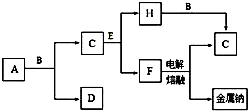 中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).
中学化学中常见的几种物质存在如图所示的转化关系,其中,A是一种黑色粉末状固体,C是一种黄绿色气体.实验室中常用E溶液吸收多余的C.(图中部分产物和反应条件已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaCl 溶液中含有Cl-的数目为NA | |
| B. | 78g 苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
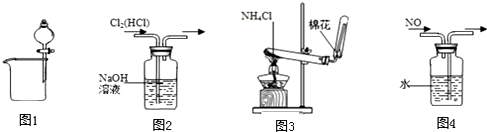
| A. | 图1可用于分离碘酒中的碘和酒精 | B. | 图2可用于除去Cl2中的HCl | ||
| C. | 图3可用于实验室制取氨气 | D. | 图4可用于排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响 | |
| B. | 图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响 | |
| C. | 图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com