
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) 
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
【答案】B
【解析】解:根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O.
A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大,因此原子半径Al>S>O,故A正确;
B、由于非金属性:N>Si,所以最高价氧化物对应水化物的酸性:HNO3>H2SiO3 , 故B错误;
C、由于非金属性:O>Si,所以气态氢化物的稳定性:H2O>SiH4 , 故C正确;
D、O原子含有2个电子层,最外层含有6个电子,因此O位于元素周期表中第二周期、第ⅥA族,故D正确;
故选:B.
根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O.
A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大;
B、根据非金属性越强,最高价氧化物对应水化物的酸性越强分析;
C、根据非金属性越强,气态氢化物的稳定性越强分析;
D、根据O原子含有2个电子层,最外层含有6个电子分析.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列化学用语使用正确的是( )
A.二氧化碳分子的结构式为 O﹣C﹣O
B.氟化钠的电子式: ![]()
C.F原子的结构示意图: ![]()
D.用电子式表示氯化氢分子的形成过程: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe+3Br2=2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。则下列叙述不正确的是
A. 当a=0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br-有一半被氧化时,c(Fe3+)∶c(Br-)∶c(Cl-)=1∶1∶3
D. 当0<a<0.15时,始终有2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料。请根据下列的要求回答有关问题:
(1)氨的水溶液显弱碱性,其原因为__________________________________________________(用离子方程式表示);0.1 mol·L-1的氨水中加入少量NH4Cl固体,溶液的pH_______(选填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度________(选填“增大”或“减小”)。
的浓度________(选填“增大”或“减小”)。
(2)已知硝酸铵加热分解可得到N2O和H2O。250 ℃时,硝酸铵固体在密闭容器中分解达到平衡,该分解反应的化学方程式为:____________________________________________;平衡常数表达式为_____________________;若有1 mol硝酸铵完全分解,则发生转移的电子的物质的量为________mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如下图所示,若生成1 mol N2,该热化学方程式的ΔH=________kJ·mol-1。
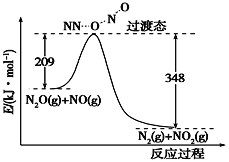
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的

A. 开始时产生的气体为H2
B. AB段产生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 参加反应铁粉的总质量m2=5.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com