
| A. | 燃烧、酸碱中和反应都是放热反应 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
分析 A、常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
B、化学反应的实质是旧键断裂吸收能量,新键形成放出能量,反应过程中一定伴随能量变化;
C、反应是吸热还是放热与反应条件无关;
D、放热反应与吸热反应取决于反应物总能量与生成物总能量的相对大小.
解答 解:A、燃烧、酸碱中和反应都是放热反应,故A正确;
B、化学反应的实质是旧键断裂吸收能量,新键形成放出能量,反应过程中一定伴随能量变化,故B正确;
C、放热反应与吸热反应取决于反应物总能量与生成物总能量的相对大小,与反应条件无关,比如多数的燃烧反应需要加热引燃,如氢气的燃烧为放热反应,需要加热,故C错误;
D、放热反应与吸热反应取决于反应物总能量与生成物总能量的相对大小,反应物总能量大,则为放热反应,反之,则为吸热反应,故D正确,
故选C.
点评 本题主要考查的是吸热和放热反应的判断,注意反应是吸热还是放热与反应条件无关,与反应物的总能量和生成物的总能量有关,难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:
如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铵
氯化铵 氢氧化钠
氢氧化钠
 ,二氧化碳
,二氧化碳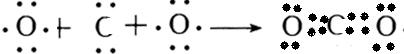
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 同一周期中,卤族元素的第一电离能最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中均存在共价键 | |
| B. | 晶体结构相似的原子晶体,共价键越弱,熔点越低 | |
| C. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| D. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com