
【题目】下面是某化学兴趣小组的同学学习元素周期律时设计的两套实验方案.
(1)【实验一】实验步骤如下:
实验序号 | 实验步骤 |
① | 向新制的Na2S溶液中滴加新制的氯水 |
② | 将镁条投入1mol/L的稀盐酸中 |
③ | 将铝条投入1mol/L的稀盐酸中 |
(i)设计该实验方案的目的是:探究同周期元素的 .
(ii)实验①的现象是 ,反应的化学方程式是 .
(2)【实验二】为验证Cl2、Br2的非金属性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图.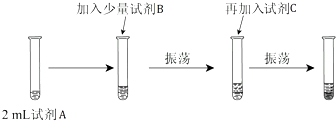
(iii)试剂A是 ;试剂B是 ;试剂C是 .
(iv)试剂C在实验中所起的作用是 ,
加入C振荡、静置后看到的现象是: .
以上反应可以证明Cl2的非金属性 (填“强于”或“弱于”)Br2的非金属性,反应的离子方程式为: .
【答案】
(1)性质(或金属性与非金属性)的递变规律;生成浅黄色沉淀|;Cl2+Na2S=S↓+2NaCl
(2)NaBr溶液;氯水;四氯化碳;萃取生成的溴,使现象更明显;;液体分成两层,上层接近无色、下层为橙色,;强于; Cl2+2Br﹣=2Cl﹣+Br2
【解析】解:【实验一】(1)(i)由实验步骤可知,实验序号①比较S、Cl的非金属性强弱,实验序号②③,比较Mg、Al的金属性强弱,所以实验目的是性质(或金属性与非金属性)的递变规律,
所以答案是:性质(或金属性与非金属性)的递变规律;
(ii)氯水与硫化钠反应生成S与NaCl,反应方程式为:Cl2+Na2S=S↓+2NaCl,现象:生成浅黄色沉淀,
所以答案是:生成浅黄色沉淀;Cl2+Na2S=S↓+2NaCl;
(2)(iii)【实验二】要想比较氯气和溴单质的氧化性大小,做如下实验:试剂A,取少量溴化钠反应→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴.
所以答案是:NaBr溶液;氯水;四氯化碳;
(iv)溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以试剂C在实验中所起的作用是萃取生成的溴,使现象更明显,加入C振荡、静置后看到的现象是:液体分成两层,上层接近无色、下层为橙色;氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ .
所以答案是:萃取生成的溴,使现象更明显;液体分成两层,上层接近无色、下层为橙色,强于 Cl2+2Br﹣=2Cl﹣+Br2 .


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: 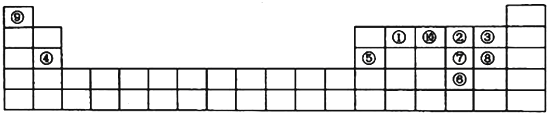
(1)在这10种元素中,非金属性最强的是(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为 , 元素②与⑨形成的18e﹣化合物的电子式;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:>(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列醛、酮的反应属于还原反应的是( )
A.醛的银镜反应
B.醛在空气中久置变质
C.由2-丁酮制备2-丁醇
D.乙醛与新制的氢氧化铜悬浊液加热有砖红色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列将CH3CHO和CH3COOH分离的正确方法是( )
A.蒸馏
B.加入Na2CO3溶液后,通过萃取的方法分离
C.加入烧碱溶液后蒸馏出乙醛,再加入浓硫酸,蒸馏出乙酸
D.和Na反应后进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 , 该反应为反应(填“放热”或“吸热”).
(2)t1=s,完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度) .
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是 .
(4)t1(填“>”或“<”)t4 , 原因是 .
t2t3(填“>”或“<”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.石英与烧碱溶液共热:SiO2+2OH﹣ ![]() SiO32﹣+H2O
SiO32﹣+H2O
B.在氯化铝溶液中滴加过量的氨水:Al3++4OH﹣=[Al(OH)4]﹣
C.在氢氧化钠溶液中通入过量的CO2:2OH﹣+CO2=CO32﹣+H2O
D.稀硫酸与氢氧化钡溶液反应H++SO42﹣+Ba2++OH﹣=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱﹣192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( ) 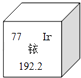
A.铱的相对原子质量为192.2克
B.铱原子核内的中子数为77
C.K2IrO3中Ir的化合价为+4
D.生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 11gT2O含有的电子数为5NA
B. 常温下,0.2L 0.5molL﹣1NH4NO3溶液的氮原子数小于0.2NA
C. 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA
D. 标准状况下,2.24L H2S全部溶于水所得溶液中HS﹣和S2﹣离子数之和为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com