
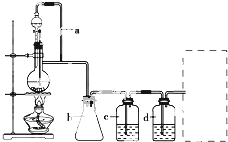
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2So4 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
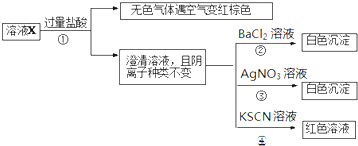
| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
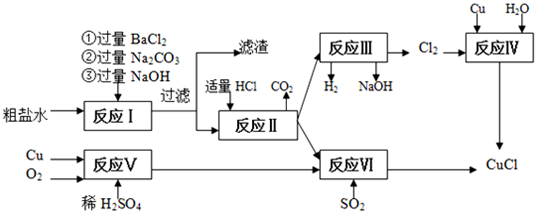
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
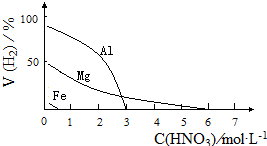 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入 | 在该浓度的稀HNO3中,Mg能反应, |
| HNO3浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入 | 硝酸浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锂 | X | |
| 失去第一个电子(I1) | 519 | 580 |
| 失去第二个电子(I2) | 7296 | 1820 |
| 失去第三个电子(I3) | 11799 | 2750 |
| 失去第四个电子(I4) | 11600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com