
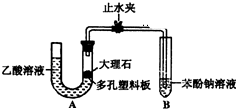
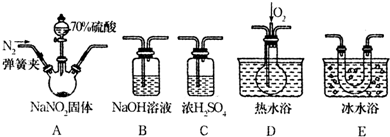
 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去).
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了如图的实验装置(夹持仪器已略去). -ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号)
-ONa溶液的pH,其pH由大到小排列的顺序为bdac (填溶液编号) 分析 (1)根据体系内产生的压强是否变化来判断装置的气密性,碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳;
(2)二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,根据离子方程式的书写规则书写;
(3)要防止醋酸干扰实验,在气态未和苯酚反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体;
(4)证明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化分析判断是否存在电离平衡分析设计;
(5)都是强碱弱酸盐,溶液显示碱性,酸根离子对应的酸的酸性越弱,水解程度越大,溶液的pH越大,据此进行判断各溶液的pH大小.
解答 解:(1)U型管两侧液面差能产生压强,所以能判断装置的气密性,故正确;碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳,反应方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O,
故答案为:正确;CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O;
(2)二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,所以看到的现象是溶液出现浑浊,反应离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:试管中溶液出现浑浊;C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)要防止醋酸干扰实验,在气态未和苯酚反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体,所以在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶除去醋酸,
故答案为:在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶;
(4)明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化,实验步骤为:取pH=3的乙酸溶液加入蒸馏水稀释100倍,用pH试纸测定溶液的pH小于5,
故答案为:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案);
(5)a.NaHCO3溶液 b.Na2CO3溶液 c.CH3COONa溶液 d. -ONa,以上都是强碱弱酸盐,溶液都显示碱性,化学式中含有的弱酸根离子对应的酸的酸性越强,其水解程度越弱,溶液的pH越小,而酸性关系为:醋酸>碳酸>苯酚>碳酸氢根离子,则以上溶液的pH由大到小排列的顺序为bdac,
-ONa,以上都是强碱弱酸盐,溶液都显示碱性,化学式中含有的弱酸根离子对应的酸的酸性越强,其水解程度越弱,溶液的pH越小,而酸性关系为:醋酸>碳酸>苯酚>碳酸氢根离子,则以上溶液的pH由大到小排列的顺序为bdac,
故答案为:bdac.
点评 本题考查了比较弱酸酸性强弱的方法、证明弱电解质的方法,题目难度中等,注意掌握比较弱电解质酸性强弱常用的方法,明确判断盐的水解程度的方法:越弱越水解.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题
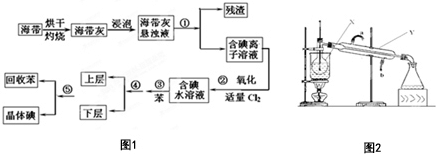 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2)
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海带中提取碘的流程图如图1:(已知:Cl2+2I-═2Cl-+I2) 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取CuO2的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
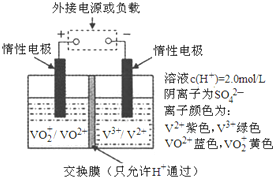 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com