
关于下列各装置图的叙述中,正确的是
A.若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
科目:高中化学 来源: 题型:
第3周期元素的基态原子中,不可能出现d电子,主要依据是
A.能量守恒原理 B.泡利不相容原理
C.洪特规则 D.近似能级图中的顺序3d轨道能量比4s轨道高
查看答案和解析>>
科目:高中化学 来源: 题型:
判断同分异构体的种类(不考虑立体异构):
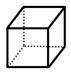 (1)某烷烃的相对分子质量为114,且分子中含有两个相同的支链,则该烷烃可能的结构共有 种;
(1)某烷烃的相对分子质量为114,且分子中含有两个相同的支链,则该烷烃可能的结构共有 种;
(2)“立方烷”(如图)与氯气发生取代反应,生成的二氯代物共有______种;
(3)甲苯的二氯取代物共有______种;
(4)“金刚烷”(如图),它可看作是由四个等同的六元环组成的空间构型。
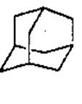 请判断:
请判断:
①一溴代物有 种;
②由氯原子 取代金刚烷亚甲基(-CH2-)中氢原子所形的二氯取代物共有______种。
取代金刚烷亚甲基(-CH2-)中氢原子所形的二氯取代物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
A.1.14g B.1.6g C.2.82g D.4.36g
查看答案和解析>>
科目:高中化学 来源: 题型:
把铝、铁混合物1.1 g溶于200 mL 5 mol/L盐酸中,反应后盐酸的浓度变为4.6 mol/L (溶液体积变化忽略不计)。
(1)反应中消耗HCl的物质的量 mol。
(2)该混合物中铝的质量为 g,铁的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生
产中保持恒温恒容条件):
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是
A.向装置中充入N2 B.向装置中充入过量的SO2
C.向装置中充入O2 D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及
固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一
反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g) 、3.5 mol O2
(g) 、1mol SO3 (g) ,下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
 D.第二次平衡时SO3的体积分数等于2/9
D.第二次平衡时SO3的体积分数等于2/9
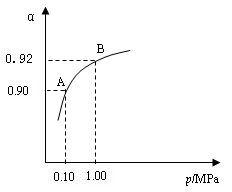
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是: ,并比较不同压强下的平衡常数:K(0.10 MPa)
K(1.0 MPa)(填 “<”或“>”或“=”)。
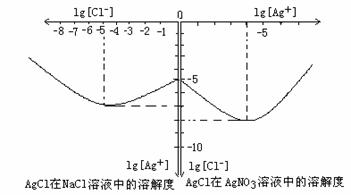 ⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- = [AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为 。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A. ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B. NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为____________________________________________________________。
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为__________________________。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为__________________________。
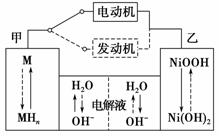
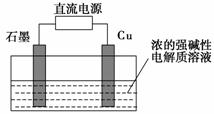
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,利用_____________保护法。或与像铅酸蓄电池这样的直流电源的____________(填“正”或“负”)极相连。利用_____________保护法防止其被腐蚀。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Co2O3在酸性溶液中易被还原成Co2+;Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A. 3Cl2+6FeI2=2FeCl3+4FeI3 B. Cl2+FeI2=FeCl2+I2
C. Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D. 2Fe2++ I2=2Fe3++2I-
D. 2Fe2++ I2=2Fe3++2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com