
| 选项 | 操作和现象 | 结论 |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的$\frac{2}{3}$处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠和氧气在没有条件的条件下反应生成氧化钠,在空气中燃烧生成过氧化钠;
B.酸性条件下,亚铁离子能被硝酸根离子氧化生成铁离子;
C.二氧化硫具有还原性,能被强氧化剂氧化;
D.二氧化氮和水反应生成硝酸和NO,NO和氧气反应生成二氧化氮,从而原料充分利用.
解答 解:A、切开金属钠,钠表面的银白色会逐渐褪去形成白色固体氧化钠,不是过氧化钠,故A错误;
B、Fe(NO3)2溶液中滴入稀硫酸,发生反应3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故B错误;
C、二氧化硫具有还原性被氧化剂高锰酸钾氧化为硫酸,溶液颜色褪去,不是二氧化硫的漂白性,故C错误;
D、二氧化氮和水反应生成硝酸和一氧化氮,通入氧气,一氧化氮和氧气按照4:3恰好溶于水形成硝酸溶液;原料充分利用防止气体污染空气,气体溶于水全部形成硝酸,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及氧化还原反应、元素化合物性质,明确实验原理、物质性质是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
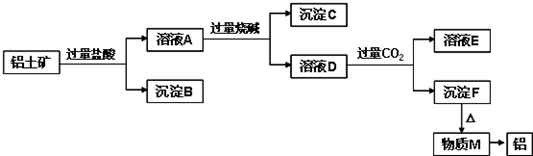
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
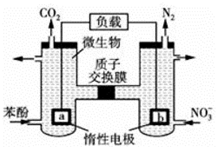
| A. | a电极反应式为C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| B. | 电子流向为a→负载→b→质子交换膜→a | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 当有1mol电子转移时,正极产生2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| B. | 一定量的浓硫酸与Xg Zn反应,若转移的电子为0.4 mol,则参加反应的硫酸分子数目一定等于0.4NA | |
| C. | 高温下,16.8g Fe与足量水蒸气反应,转移的电子数为0.7NA | |
| D. | 向含有0.2 mol FeCl3的两份溶液中分别滴加过量Na2S、通入过量H2S气体,则产生的沉淀比为:$\frac{0.3{N}_{A}}{0.1{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:4:3 | B. | 2:4:5 | C. | 2:4:7 | D. | 3:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
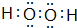 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
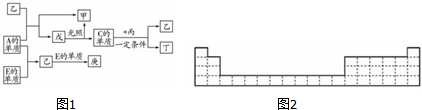
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
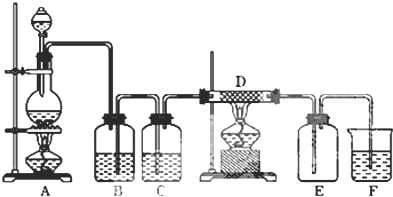
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
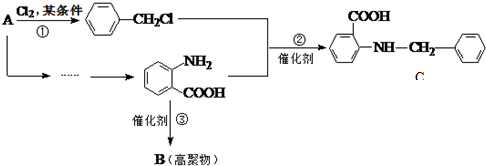
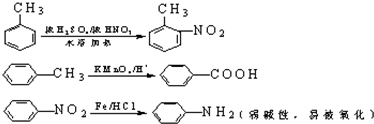
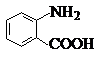 中官能团的名称氨基、羧基.
中官能团的名称氨基、羧基.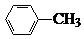 +Cl2$\stackrel{光}{→}$
+Cl2$\stackrel{光}{→}$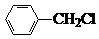 +HCl.
+HCl.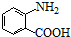 多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式
多一个碳的同系物,则满足下列条件的D的同分异构体共有19种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式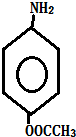 等.
等. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com