
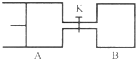
 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
| 4mol |
| 0.8 |
| 0.5mol |
| 2mol |
| 0.8a |
| 4mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:2:3 |
| C、1:3:2 |
| D、3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被氧化的元素原子个数与被还原的元素原子之比为6:1 |
| B、还原产物与氧化产物的质量之和为287.5g |
| C、KClO3失去6mol电子,HCl得到6mol电子 |
| D、ClO3-和Cl-在酸性环境中可能不能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol | ||||
| B、25℃、101 kPa时,1mol S和2mol S的燃烧热不相等 | ||||
C、含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+
| ||||
| D、已知I2(g)+H2(g)═2HI(g)△H1,I2(s)+H2(g)═2HI(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A、元素Y的常见化合价是+3价 |
| B、元素X是ⅠA族的元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、若元素Y处于第3周期,Mg(OH)2碱性弱于Y(OH)m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol |
| B、0.4mol |
| C、0.6mol |
| D、0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaHSO4溶液与Ba(OH)2溶液反应至中性H++SO
| ||
| B、NaClO溶液与FeCl2溶液混合Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | ||
C、NH4HSO3溶液与足量NaOH溶液反应NH
| ||
D、0.2 mol?L-1的NH4Al(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合 2Al3++3SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com