
物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题: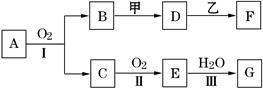
请回答些列问题:
(1)写出甲的电子式是 .
(2)写出反应Ⅰ的化学方程式 .
(3)A溶于水得到得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为 用含a和b的代数式表示出该混合溶液中X的电离平衡常数 .
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图装置处理污水.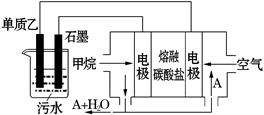
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ. ;Ⅱ. .
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .
(每空2分,共14分)
(1)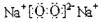 (2分) (2)4NH3+5O2
(2分) (2)4NH3+5O2 4NO+6H2O (2分)
4NO+6H2O (2分)
(3)c(NO3—)=c(NH4+)>c(OH—)= c(H+) ; 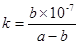 (各2分,共4分)
(各2分,共4分)
(4)①Al-3e— = Al3— ; 4OH- - 4e-= 2H2O + O2↑ ②CO2(各2分,共6分)
解析试题分析:
(1)由题干信息可知甲为过氧化钠;
(2)反应Ⅰ涉及氨的催化氧化;
(3)溶液X为氨水。如果溶液呈中性,则氨水过量,混合后的溶质为NH4NO3和NH3·H2O,根据溶液中电荷守恒,可得:c(NO3—)=c(NH4+)>c(OH—)= c(H+)
NH3·H2O  NH4+ + OH—
NH4+ + OH—
K = 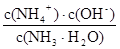
c(NH4+)= c(NO3—)=b mol·L-1; c(OH—)=10-7 mol·L-1 ; c(NH3·H2O)=(a – b) mol·L-1
代入计算可得答案。
(4)单质乙为Al,非惰性电极做阳极,优先放电,同时OH—在阳极也会放电。
熔融的碳酸盐为电解质,则正极反应为:2O2 + 8 e- + 4CO2 = 4CO32-
负极反应为:CH4 – 8 e- +4CO32- = 5CO2 + 2H2O
所以必须有CO2参与循环反应。
考点:本题考查了溶液中三个守恒关系式,化学平衡常数的计算,电极反应方程式的书写等,综合性比较强,要求学生分析问题,提取题干信息的能力。


科目:高中化学 来源: 题型:填空题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。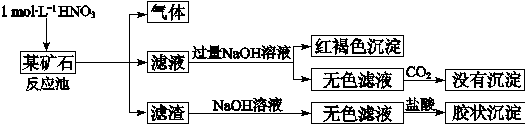
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题: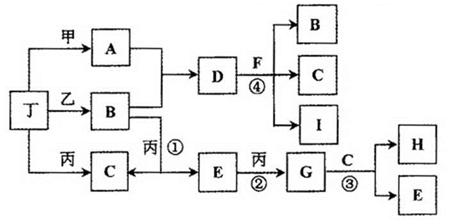
(1)反应④的化学方程式为 。
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)在恒温恒压容器中加入一定量B,催化条件下发生反应B 乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
乙+丁(未配平),达平衡后再加少量B,则平衡 移动(填“正向”、 “逆向”或“不”),重新平衡后与原平衡相比,B的转化率 (填“增大”、 “减小”或“不变”)。
(4)常温下,物质的量浓度相同的A、B、D三者的水溶液,由水电离出的c(OH-)大小顺序是(用A、B、D表示) 。
(5)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(6)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系:
(1)推断化学式:X ;A ;B ;D 。
(2)写出C→E反应的化学方程式 。
(3)写出X→A反应的离子方程式(OH-足量) 。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是中学常见的5种化合物,A、B是金属氧化物且A是红棕色固体,元素X、Y、Z是中学化学中常见的单质,相关物质间的关系如下图所示。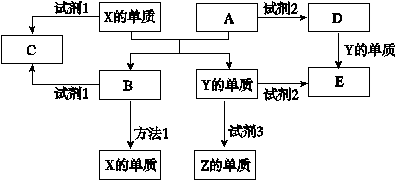
(1)工业上得到单质X的冶炼方法1是 。
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3 反应的化学方程式是 。
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式 。
(4)若试剂2是盐酸。
①如何检验D物质中的金属阳离子 。
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。
请回答:(1)写出F的电子式 。(2)G的结构式是 。
(3)反应④是 反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时: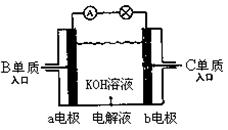
①b电极附近溶液的pH将 (填“增大”“减小”“不变”);
②a电极上的电极反应式为: 。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列各反应现象所归纳的元素性质不正确的是
| A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出。不能说明钠的金属性比铜弱 |
| B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝。说明氯元素的非金属性比碘元素强 |
| C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出。说明Cl的非金属性比S强 |
| D.将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol。说明这三种金属的活泼性为:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下述实验设计能够达到目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 证明Ksp(AgCl)﹥Ksp(AgI) | 往AgCl悬浊液中滴入KI浓溶液 |
| B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从下列事实所得出的相应结论正确的是( )
| | 实验事实 | 结论 |
| ① | 在相同温度下,向1 mL 0.2 mol·L-1 NaOH溶 液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生 白色沉淀后,再滴加2滴0.1 mol·L-1 FeCl3 溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 已知反应5Cl2+I2+6H2O=2HIO3+ 10HCl,2BrO+Cl2=2ClO+Br2 | 氧化性强弱顺序:BrO>Cl2>ClO>IO |
| ④ | 测定等物质的量浓度的Na2SO4与Na2CO3溶 液的pH,后者较大 | 非金属性:S>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com