

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
分析 (1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,据此计算;
(2)①根据题目信息写出生成物,根据质量守恒配平;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,正极上是次氯酸根离子得到电子生成氯离子;
(3)①根据v=$\frac{△c}{△t}$计算v(H2),再根据速率之比等于化学计量数之比计算v(CO2);
②a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变;
c.恒容条件下,反应物和产物都是气体,密度始终不变;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
解答 解:(1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,所以每转移1mole-,可放出的热量为132.6kJ,
故答案为:132.6kJ;
(2)①用CO还原MgSO4可得到MgO、CO2、SO2和SO3,方程式为CO+2MgSO4 $\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3;
故答案为:CO+2MgSO4 $\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3;
②由图可知镁-次氯酸盐”燃料电池中Mg与ClO-、H2O反应生成Cl-与Mg(OH)2,该电池反应的总反应方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2,正极电极反应是ClO-离子得到电子发生还原反应,电极反应为:ClO-+2e-+H2O=Cl-+2OH-,负极电极反应是Mg失去电子发生氧化反应,电极反应为:Mg-2e-+2OH-=Mg(OH)2,
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
(3)①v(H2)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(H2)=0.15mol/(L.min),
故答案为:0.15mol/(L.min);
②②a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态,故a正确;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变,故b错误;
c.恒容条件下,反应物和产物都是气体,密度始终不变,故c错误;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等,说明反应处于平衡状态,故d正确;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变,所以不能说明反应是否处于平衡状态,故e错误,
故选:ad;
③c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等,故b点υ正>υ逆;
该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行,故t3~t4时刻,H2O(g)的转化率降低,
故答案为:>;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
点评 本题考查的知识点较多,既考查了电化学又考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息写电极反应,要求学生有较好从图中获取信息的能力,整个题目难度较大.本题考查化学平衡计算、平衡状态判断、化学平衡影响因素、原电池等,注意理解掌握化学平衡常数的应用.


科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电解过程中溶液pH不会变化 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考虑活塞的摩擦)下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入CO2体积为2.24L(标准状况) | |
| B. | NO2转化为N2O4的转换率为20% | |
| C. | 活塞移至C处后,继续通入0.01mol CO2,此时活塞恰好回到D处 | |
| D. | 若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量应大于1.56g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 银电极是负极 | B. | X电极是锌电极 | ||
| C. | 去掉盐桥电流计指针仍偏转 | D. | Y溶液为AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

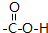 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com